ÁREA: FEPROQUIM - Feira de Projetos de Química
TÍTULO: Extração, Purificação e Determinação do Ponto Isoelétrico da Caseína do Leite
AUTORES: Andrade, J. (COLÉGIO LUMIÈRE) ; Calixto, C. (COLÉGIO LUMIÈRE) ; Gabriel, J. (COLÉGIO LUMIÈRE) ; Gomes, L. (COLÉGIO LUMIÈRE) ; Silva, T. (COLÉGIO LUMIÈRE) ; Palumbo, M. (COLÉGIO LUMIÈRE)
RESUMO: A caseína é uma proteína encontrada no leite e, assim como outras proteínas, sua
solubilidade depende de vários fatores, dentre eles o pH. Para todas as
proteínas
existem um pH no qual elas se encontram mais apolar, chamado de ponto
isoelétrico. Esse valor de pH desencadeia a formação do zwitterion, ponto no
qual ela atinge a forma mais apolar, logo, a menor solubilidade em água,
precipitando em relação ao sistema. Através de um procedimento simples, baseado
em métodos de extração, decantação e solubilização da caseína, determinou-se o
valor do ponto isoelétrico entre os pH 4,0-5,0. Com a chegada de novos
equipamentos, pretende-se determinar o valor do P.I. com maior precisão e criar
uma metodologia para evidenciar as formas positiva e negativa da proteína.
PALAVRAS CHAVES: EXTRAÇÃO; CASEÍNA; PONTO ISOELÉTRICO
INTRODUÇÃO: Leite é um líquido com alto valor nutritivo constituído por água carboidratos,
gorduras, proteínas, minerais e vitaminas (1). Este nutriente apresenta
benefícios na proteção, construção ou fortalecimento dos organismos (2).
Em geral, as proteínas são macromoléculas orgânicas formadas por aminoácidos
ligados por ligações peptídicas. Elas apresentam diversas funções no organismo
como: estrutural, hormonal, enzimática, imunológica, nutritiva e de transporte
citoplasmático (3). As proteínas constituem 3,5% do leite (4) sendo que cerca de
80% destas (5) pertencem ao grupo das caseínas, existindo cinco compostos
derivados desta substância: αs1, αs2, β, k, λ, sendo que estas se encontram
organizadas em gotículas, denominadas micelas de caseína (6). A absorção da
caseína é lenta devido à formação de um gel no intestino em presença da mesma,
tendo eficiência na redução do catabolismo muscular (evitando a quebra da massa
magra) e na estimulação da síntese proteica(6).
Como toda proteína, a caseína pode apresentar carga negativa, positiva ou
neutra, em função do pH ao qual está submetida. O valor do pH onde as proteínas
apresentam-se neutras é chamado de ponto isoelétrico e desempenha função
importante na caracterização e propriedades de todas as proteínas, afinal é
nesta forma que estes compostos apresentam a menor solubilidade em água.
O ponto isoelétrico da caseína é em pH=4,7(5). Nessas circunstâncias ela se
encontra na forma mais apolar, ou seja, apresenta baixa solubilidade,
precipitando em relação ao sistema. Em pH<4,7 ela
apresenta carga elétrica negativa e, por fim positiva em pH>4,7, sendo polar e
miscível ao leite nestas duas outras condições(7).
O projeto tem como objetivo extrair a caseína do leite e determinar o ponto
isoelétrico desta proteína.
MATERIAL E MÉTODOS: Extração, Purificação e Determinação do P.I. da Caseína do leite:
1. Materiais e reagentes: leite desnatado; solução de ácido acético
(CH3COOH)
0,01M, 0,1M, 1M e 2M; solução de hidróxido de sódio (NaOH) 0,1M; etanol
(CH3CH2OH) 95% (v/v); éter etílico
(CH3CH2OCH3CH2)- PA; béquer - 250
mL; proveta - 100 mL; conta-gotas; funil; papel de filtro; tubos
de ensaio.
2. Procedimento: Para a obtenção da caseína foram aquecidos 150 mL de água
destilada a 38°C e em seguida adicionou-se 50 mL de leite. A essa solução
adicionou-se ácido acético (aproximadamente 0,7mL) gota a gota até o
aparecimento de um precipitado abundante. A solução descansou por
aproximadamente 20 minutos para a sedimentação da proteína, e a seguir o
sobrenadante foi separado por decantação. Ao precipitado foram adicionados 20 mL
de etanol, misturou-se bem, efetuou-se a filtração e desprezou-se o filtrado.
Ao precipitado foram adicionados 5 mL de éter etílico e, após agitação,
efetuou-se uma nova filtração decantando então o precipitado, e secando-o em
papel de filtro. Pesou-se 1g da caseína obtida, adicionando 50 mL de água
destilada para a ressuspenção. Adicionou-se 25 mL da solução de NaOH, agitando
lentamente para evitar a formação de espuma, e em seguida adicionados 25 mL de
ácido acético 1M agitando cuidadosamente. Ajustou-se o pH para um valor próximo
da neutralidade utilizando ácido e base conforme necessário. Numeraram-se nove
tubos de ensaio nos quais foram adicionadas quantidades de ácido diferentes,
seguidos de 0,5 mL da solução de caseína.
RESULTADOS E DISCUSSÃO: No ponto isoelétrico há o equilíbrio entre as cargas positivas e negativas, a
carga da molécula da caseína é nula (forma zwitteriônica) o que faz com que as
que as forças de repulsão entre as moléculas de proteína e as forças de
interação com o solvente sejam mínimas, favorecendo sua separação do sistema.
Assim, as proteínas vão formando aglomerados que, cada vez maiores, tendem a
precipitar. Segundo as sondagens iniciais, o ponto isoelétrico foi atingido
quando 4,0<pH<5,0. Neste valor de pH ocorreu a maior turvação da solução dentre
os tubos de ensaio estudados que continham valores de pH entre 3 e 6. Como
provavelmente a caseína protona em pH menor que 4, tornando-se positiva e
desprotona em valores acima de 5,0, tornando-se negativa, surgiu a hipótese de
elaborar um procedimento, por eletrólise a fim de separar a forma positiva e a
negativa da caseína da solução, que está em vias de elaboração, planejamento e
execução. Em muitos procedimentos pesquisados é descrita uma etapa de
centrifugação para retirada de gordura. No desenvolvido neste projeto a retirada
da gordura é feita na etapa de extração por éter. Pretende-se ampliar o
procedimento para leite com teores de gordura diferente do desnatado.
Solubilidade da Caseína em Diferentes pH

Tubos de ensaio com valores de pH variando de 3 a
6, em destaque, o tubo número 4.
Visualização da Turbidez da Caseína em Função do pH
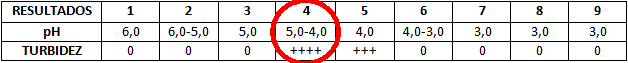
Em destaque, o tubo 4, no qual a caseína turvou em
solução com maior intensidade. Os sinais positivos
indicam a maior intensidade de turbidez.
CONCLUSÕES: As proteínas apresentam solubilidades variadas em função do pH e cada uma delas
possui ponto isoelétrico próprio, no qual a estrutura apresenta a menor
solubilidade em água.
Pelos resultados obtidos, até este momento, pode-se afirmar que o ponto
isoelétrico da caseína encontra-se entre o pH 4 e 5, nas cercanias do valor
encontrado em literatura que é de pH=4,7, comprovando a eficiência das etapas de
separação descritas pelo método.
Fora desta região a caseína é solúvel, devido a polarização da sua estrutura.
O projeto terá continuidade mediante aceite para participação do congresso.
AGRADECIMENTOS: Agradecemos a Deus pela oportunidade, aos nossos pais pelo apoio e aos
orientadores Marcio e Thalita pela dedicação e empenho em ajudar no nosso
trabalho.
REFERÊNCIAS BIBLIOGRÁFICA: 1.Composição Química do Leite. Disponível em <http://www.cquali.gov.br/data/Pages/MJ8F0048E8ITEMIDFBD8A1EB007A4CADBEF09F29C15C6431PTBRNN.htm>. Acesso em 02 junho 2012;
2.LAY-ANG, G., A Importância do Leite.2010. Disponível em<http://www.sissaude.com.br/sis/inicial.php?case=2&idnot=7808>. Acesso em 02 junho 2012;
3.FONSECA, K., Proteínas. Disponível em <http://www.brasilescola.com/biologia/proteinas.htm>. Acesso em 02 junho 2012;
4.VALSECHI,O.A., O Leite e seus Derivados. 2001. Disponível em <http://www.cca.ufscar.br/~vico/O%20LEITE%20E%20SEUS%20DERIVADOS.pdf>. Acesso em 02 junho 2012;
5.Leite é Fonte de Proteínas. Disponível em <http://www.ablv.org.br/14-SaudeBemEstar-Leite-e-fonte-de-proteinas.aspx>. Acesso em 02 junho 2012;
6.Rasmussen L.K. et al., 1995. Comp. Biochem. Physiol. 111B, 75-81;
7.MIRANDA, L.F.; Bioquímica Experimental, Biomoléculas, Ed. Plêiade, São Paulo, p. 196, 2004.
