ÁREA: Iniciação Científica
TÍTULO: UM ESTUDO TEÓRICO DAS PROPRIEDADES MOLECULARES DOS COMPLEXOS DE HIDROGÊNIO ENVOLVENDO R1COCH3 (R= -C6H5, -C6H4Me, -C6H4OMe e -C6H4NO2) e R2COOH (R2= -H e –CH3)
AUTORES: Oliveira, M.S.S. (UFPE) ; Santos, V.F.C. (UFPE) ; Belarmino, M.K.L. (UFPE) ; Lima, N.B. (UFPE)
RESUMO: Neste trabalho interpretamos teoricamente como a formação da ligação de hidrogênio
pode modificar as propriedades energéticas, eletrônicas e estruturais de complexos
envolvendo quatro cetonas diferentes e dois ácidos carboxílicos {ácido acético
(CH3COOH) e ácido fórmico (HCOOH)}.Os nossos resultados mostram que a formação da
ligação de hidrogênio resulta em mudanças significativas nas propriedades
energéticas, eletrônicas e estruturais tanto das cetonas quanto dos ácidos
carboxílicos. Todas as estruturas encontradas correspondem a pontos de mínimo na
curva de potencial.
PALAVRAS CHAVES: ligação de hidrogênio; cetonas; ácido caboxílico
INTRODUÇÃO: Dentre as interações químicas, as ligações de hidrogênio (LH) ocupam um lugar de
destaque, por serem responsáveis por uma série de efeitos importantes, tais
como: transferência de carga, estabilidade energética, surgimento e deslocamento
de bandas no espectro de infravermelho, mudança na cinética da reação entre
outros [1-3]. Por resultarem em vários efeitos interessantes, as ligações de
hidrogênio podem ser aplicadas em diferentes áreas da ciência tornando assim, o
seu estudo, de grande importância. Neste trabalho estamos interessamos em
interpretar teoricamente como a formação da ligação de hidrogênio pode modificar
as propriedades energéticas, eletrônicas e estruturais de complexos envolvendo
quatro cetonas diferentes e dois ácidos carboxílicos {ácido acético (CH3COOH) e
ácido fórmico (HCOOH)}
MATERIAL E MÉTODOS: Neste trabalho, nós empregamos cálculos de orbitais moleculares usando a teoria do
funcional de densidade (DFT)[4] com o funcional B3LYP[5] com o conjunto de funções
de base 6-31++G(d,p). Também foi utilizado o programa de química quântica
computacional GAUSSIAN 03.
RESULTADOS E DISCUSSÃO: Através da figura 2 é possível observar que provavelmente a interação via duas
ligações de hidrogênio para este grupo de cetonas e RCOOH (R= -H e -CH3), parece
haver a formação de uma espécie de ciclo de nove membros.
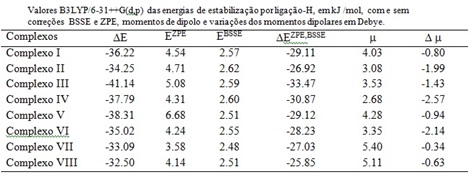
A tabela 1 apresenta os valores das energias de estabilização (DE), as correções
do ponto zero (EZPE), as correções do erro da superposição de base (EBSSE), e as
energias de estabilização com ambas as correções ZPE e BSSE (DEZPE, BSSE). Nesta
tabela também mostramos os valores de momento de dipolo dos complexos (m) e
variação do momento de dipolo {Dm=m(complexo - mmoléc. isoladas)}.
Analisando os valores referentes ás energias de estabilização, é possível
verificar que os maiores valores são observados para os complexos envolvendo
RCOCH3(R= -C6H5OMe) e os menores valores para os complexos envolvendo RCOCH3
(R= -C6H5NO2). Acreditamos que tendo um grupo retirador de elétrons (NO2) no
anel aromático, o complexo se torna menos estável comparando com os complexos
que não possuem este grupo retirador de elétrons.
Entretanto, de maneira geral, os complexos formados via ligação de hidrogênio
entre este grupo de cetonas e RCOOH (R= -H e -CH3), verificamos que as ligações
de hidrogênio são estáveis energeticamente.
É importante ressaltar que a ligação de hidrogênio é formada via uma de carga
eletrônica no sentido par de elétrons isolado do oxigênio das cetonas → orbital
lumo dos ácidos RCOOH. Isto ocasiona mudanças interessantes nas propriedades
estruturais tanto da cetona quanto do ácido carboxílico. Por exemplo, o
comprimento da ligação OH é aumentada após a complexação. Isto indica que
provavelmente a complexação enfraquece a ligação OH.
Figura 1

Geometrias otimizadas dos oito complexos de
hidrogênio. Comprimento das ligações-H em Å.
Tabela 1
CONCLUSÕES: Os nossos resultados mostram que a formação da ligação de hidrogênio resulta em
mudanças significativas nas propriedades energéticas, eletrônicas e estruturais
tanto das cetonas quanto dos ácidos carboxílicos. Todas as estruturas encontradas
correspondem a pontos de mínimo na curva de potencial.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] Nascimento, Renata X. D., Belarmino, Márcia K. D. L., Lima, Nathália B. D., International Journal of Quantum Chemistry,(2012), DOI: 10.1002/qua.24091
[2] C. B. Aakeröy, M. Fasulo, N. Schultheiss, J. Desper, and C. Moore, J. Am. Chem. Soc.,(2007), 129, 13772.
[3] M. Solimannejad, I. Alkorta, and J. Elguero, J. Phys. Chem. A,(2007), vol. 111, p. 2077.
[4] A.D. Becke, J. Chem., Phy., (1993), 98, 5648.
[5] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev., (2003), 103, 1793.
