ÁREA: Iniciação Científica
TÍTULO: UM ESTUDO TEÓRICO SOBRE AS PROPRIEDADES VIBRACIONAIS DOS COMPLEXOS ENVOLVENDO FOSFORADOS e RCOOH(R= -H e –CH3)
AUTORES: Oliveira, M.S.S. (UFPE) ; Santos, V.F.C. (UFPE) ; Belarmino, M.K.L. (UFPE) ; Lima, N.B. (UFPE)
RESUMO: Neste trabalho apresentamos as mudanças nas propriedades vibracionais de complexos
de hidrogênio envolvendo óxido de trimetil fosfina (tmpo) e sulfeto de
trimetilfosfina (tmps), com diferentes ácidos carboxílicos {RCOOH (R= -H e -CH3}.
Nossos cálculos mostram que quatro diferentes complexos envolvendo TPPX (X= O e S)
e RCOOH (R= -H e –CH3)podem ser formados, os quais correspondem a pontos de mínimo
na curva de potencial. Em particular, as frequências do estiramento O-H deslocam
para menores valores e suas respectivas intensidades são aumentadas.
PALAVRAS CHAVES: ligação de hidrogênio; fosforados; frequência vibracional
INTRODUÇÃO: O conceito de ligações de hidrogênio sendo a ligação formada entre um grupo
doador de prótons e um grupo aceptor de prótons contendo um par de elétrons
isolados é bem aceito e utilizado em várias áreas da química, física, biologia
entre outras [1]. A formação das ligações de hidrogênio normalmente ocasiona
modificações importantes em várias propriedades moleculares, por exemplo, nas
propriedades espectroscópicas do grupo aceptor e doador de prótons[2].
Neste trabalho apresentaremos as mudanças nas propriedades vibracionais de
complexos de hidrogênio envolvendo óxido de trimetil fosfina (tmpo) e sulfeto de
trimetilfosfina (tmps), com diferentes ácidos carboxílicos {RCOOH (R= -H e -
CH3}.
MATERIAL E MÉTODOS: Para realizar esse estudo, nós utilizamos cálculos de orbitais moleculares usando
a teoria do funcional de densidade (DFT)[3] com o funcional B3LYP[4] com o
conjunto de funções de base 6-31++G(d,p). Também utilizamos o programa de química
quântica computacional GAUSSIAN 03.
RESULTADOS E DISCUSSÃO: Nossos cálculos mostram que os complexos envolvendo TPPX (X= O e S) e RCOOH (R=
-H e –CH3) correspondem a pontos de mínimo na curva de potencial, uma vez que
não apresentaram frequência negativa. As geometrias encontradas para estes
complexos são apresentados na figura 2.
Através da figura 2 acreditamos que duas diferentes ligações de hidrogênio são
formadas, OH˖˖˖X e CO˖˖˖H, sendo a primeira energeticamente mais forte. Isto
indica que provavelmente um ciclo de nove membros é formado após a complexação.
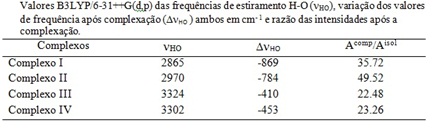
A tabela 1 apresenta os valores mais relevantes das mudanças nas propriedades
vibracionais ocasionadas pela formação da ligação de hidrogênio. No caso,
observamos que o estiramento O-H do ácido carboxílico é o estiramento mais
modificado após a complexação. Conseguimos observar dois fenômenos
interessantes, o primeiro é a grande variação nos valores de frequência,
chegando a deslocar 869 cm-1 para o vermelho no espectro vibracional para o
complexo I. O segundo fenômeno é o aumento da intensidade associada a frequência
destes estiramento. Para o complexo II a intensidade do estiramento OH é 49
vezes maior comparando com a intensidade do estiramento OH na molécula livre, ou
seja, sem estar complexada.
Acreditamos que estes dois fenômenos podem ser explicados pelo entendimento de
como a ligação de hidrogênio é formada. O processo da formação da ligação de
hidrogênio ocorre via uma transferência de carga no sentido par de elétrons
isolado do oxigênio da molécula fosforada para o orbital lumo do ácido
carboxílico. Esta transferência de carga provavelmente ocasionou as mudanças
vibracionais observadas.
Figura 1.
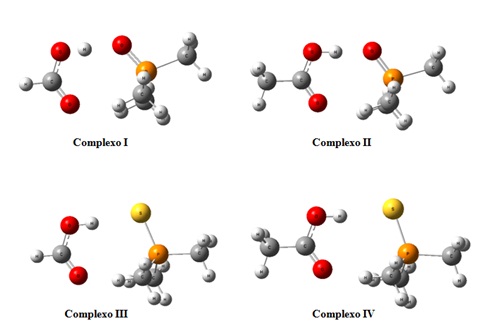
Geometrias otimizadas dos complexos de hidrogênio
envolvendo TPPX (X= O e S) e RCOOH (R= -H e –CH3).
Tabela 1
CONCLUSÕES: Nossos cálculos mostram que os complexos envolvendo TPPX (X= O e S) e RCOOH (R= -H
e –CH3) correspondem a pontos de mínimo na curva de potencial. Em particular, as
frequências do estiramento O-H deslocam para menores valores e suas respectivas
intensidades são aumentadas.
AGRADECIMENTOS: Os autores agradecem a PROPESQ/UFPE, CNPQ, FACEOE e CAPES pelo suporte financeiro.
REFERÊNCIAS BIBLIOGRÁFICA: [1] E. S. Kryachko, J. Mol. Struct., (2008), 880, 23.
[2] Nascimento, Renata X. D., Belarmino, Márcia K. D. L., Lima, Nathália B. D., International Journal of Quantum Chemistry,(2012), DOI: 10.1002/qua.24091.
[3] M. Solimannejad, I. Alkorta, and J. Elguero, J. Phys. Chem. A,(2007), vol. 111, p. 2077.
[4] A.D. Becke, J. Chem., Phy., (1993), 98, 5648.
[5] P. Geerlings, F. De Proft, W. Langenacker, Chem. Rev., (2003), 103, 1793.
