ÁREA: Materiais
TÍTULO: ESTUDO DA DECOMPÓSIÇÃO TÉRMICA DO SULFATO DE GADOLÍNIO HIDRATADO Gd2(SO4)3 . 8 H2O.
AUTORES: Rodrigues, R.V. (UFES) ; Matos, J.R. (USP) ; Machado, L.C. (UFES) ; Muri, E.B. (UFES) ; Salvador, F.F. (UFES)
RESUMO: Também conhecidos como Terras Raras (TR) os lantanídeos são um grupo em particular
de metais que apresentam características muito semelhantes entre si. A diferença
significante entre os lantanídeos deriva de seu tamanho, mas com novos estudos e
descobertas sobre estes elementos foi possível determinar características
particulares e únicas entre seus elementos e a variedade de compostos formados por
eles. Terras raras quando submetidos a tratamento térmico estabilizam-se como
oxissulfetos e oxissulfatos, compostos que tem despertado grande interesse devido
á suas aplicações na área industrial, os oxissulfetos e oxissulfatos de Gd3+ são
bastante utilizados como matrizes para dispositivos eletroluminescentes quando
dopados com Eu3+ ou Tb3+.
PALAVRAS CHAVES: TERRAS RARAS; OXISSULFETOS; OXISSULFATOS
INTRODUÇÃO: Oxissulfatos (Ln2O2SO4) / oxissulfetos (Ln2O2S) de lantanídeos (onde Ln = La,
Pr, Nd, Sm, Eu, Gd e Tb) têm sido produzidos a partir da decomposição térmica de
sulfatos hidratados ou de sulfonatos (RODRIGUES 2012) de lantanídeos a
temperaturas superiores a 800 ° C por 5 horas sob atmosfera dinâmica de N2 ou
ar. A redução do Ln2O2SO4 preparado sob uma atmosfera dinâmica de H2 a 800 °C
leva a um oxissulfeto Ln2O2S de fase única. A reversibilidade para alguns
oxissulfetos Ln2O2S pode ser obtida no intervalo de temperatura de 800-900 °C e
2 mols de O2. Diferentemente, a reoxidação do oxissulfeto Pr2O2S (S2-) para
oxissulfato Pr2O2SO4 (S6-) ocorre em temperaturas <600 º C. Atipicamente, o
tratamento térmico de sulfato de cério hidratado sob atmosfera dinâmica de O2 só
produz óxido. (IKEUE 2008, LLANOS 2002, MACHIDA 2005, 2007)
Metodologias atuais mostram que dependendo do precursor os oxissulfetos
produzidos a partir da atmosfera de monóxido de Carbono (CO) são obtidos a uma
temperatura inferior ao da atmosfera de H2.
Este trabalho tem como objetivo sintetizar o sulfato de Gd3+ [Gd2(SO4)3],
analisando e interpretando a sua estabilidade a partir dos oxissulfetos
oxissulfatos de Gd3+ gerados após o tratamento térmico do sulfato sob diferentes
atmosferas.
MATERIAL E MÉTODOS: Para a síntese do Sulfato de Gd3+ foi utilizado o óxido de Gadolínio Gd2O3, em
presença de solução de ácido clorídrico [HCl(aq)] para a abertura do óxido o que
faz com que a solução passe a incolor na formação do Cloreto de Gd3+, seguido da
adição de ureia [(NH2)2CO], o que faz com que o pH da solução seja elevada de 1
para aproximadamente 5,5 quando se inicia a precipitação do carbonato básico de
Gadolínio Gd(OH)CO3 gelatinoso e insolúvel, seguido da adição de água para a
elevação do pH para 7, garantido a precipitação total do carbonato básico de
Gd3+.
O mesmo foi retido por filtração e purificado. Posteriormente foi adicionado
ácido sulfúrico [H2SO4(aq)] para a formação do sulfato. Com todo o cuidado na
preparação do material sintetizado para não haver impurezas.
RESULTADOS E DISCUSSÃO: O Sulfato de Gd3+ obtido foi tratado termicamente em atmosferas dinâmicas de ar
e CO, os resultados experimentais comprovam que a decomposição térmica do
Sulfato de Gd3+ em atmosfera de ar obtém como resíduo o oxissulfato de Gd3+
[Gd2O2SO4], enquanto que submetido em atmosfera dinâmica de CO é obtido como
resíduo o oxissulfeto de Gd3+ [Gd2O2S], conforme mostrado pelas curvas de TG a
seguir:
A simulação de perda de massa do Sulfato de Gd3+ em atmosfera de ar inicia nos
intervalos de 29 – 123°C com perda de 1 H2O (exp. 2,9% / teórico 2,4%), 123 –
405°C (exp. 16,4% / teórico 16,8%) com perda de 7 H2O, e 405 – 1087°C (exp.
21,44% / teórico 21,54%) com perda de 2 SO3, resultando em um resíduo de ( exp.
59,26% / 59,2 %) atribuído ao oxissulfato de Gd3+ Gd2O2SO4. Por outro lado a
simulação de perda de massa so sulfato de Gd3+ em atmosfera de CO resulta nos
intervalos de 28 – 117°C (exp. 1,4% / teórico 1,23%) com uma perda de 0,5 H2O,
117 – 382°C (exp. 16,5% / teórico 17,1%) com perda de 7 H2O, e 382 – 824°C (exp.
30,7% / teórico 30,07%) com perda de 2 S + 5 O2, resultando em um resíduo (exp.
51,4% / 51,6%) atribuído ao oxissulfeto de Gd3+ Gd2O2S.
FIGURA 1

Curva de TG do Gd2(SO4)3 . 8 H2O obtida sob
atmosfera dinâmica de ar, com vazão de 50 mL/min e
taxa de aquecimento de 10°C/min até 1100°C.
FIGURA 2
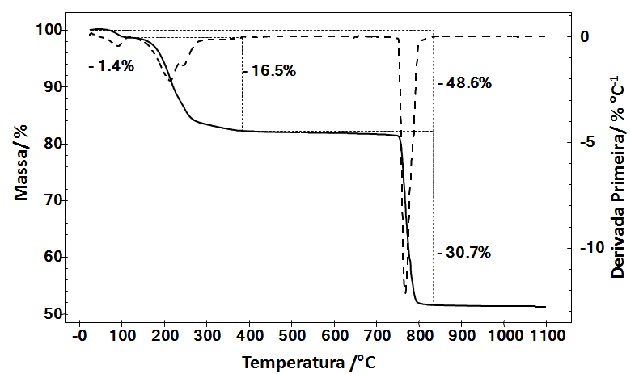
Curva de TG do Gd2(SO4)3 . 8 H2O obtida sob
atmosfera dinâmica de CO, com vazão de 50 mL/min e
taxa de aquecimento de 10°C/min até 1100°C.
CONCLUSÕES: Através da técnica de Análise Térmica (TG) e da Análise Térmica Diferenciada
(DTG), foi possível acompanhar a decomposição térmica do Sulfato de Gd3+ e propor
uma simulação da fórmula molecular do resíduo obtido, confirmando os cálculos
teóricos correspondentes, em temperaturas estáveis para estes compostos . Com isso
podemos comprovar que a decomposição Térmica do Sulfato de Gd3+ em atmosfera de ar
nos dá um resíduo como sendo o Oxissulfato de Gd3+ [Gd2O2SO4], enquanto que na
atmosfera redutora de CO obtivemos um resíduo atribuído ao Oxissulfeto de Gd3+
[Gd2O2S].
AGRADECIMENTOS: A UNIVERSIDADE FEDERAL DO ESPÍRITO SANTO - UFES
A UNIVERSIDADE DE SÃO PAULO - USP
A CAPES
REFERÊNCIAS BIBLIOGRÁFICA: RODRIGUES, R. V ; MATOS, J. R. ; Machado L. C. ; Emanuel ; MARINS, A. A. L. . Estudo do Comportamento Térmico do Sulfato e do Difenil-4-Amina Sulfonato de Térbio III. In: VIII CONGRESSO BRASILEIRO, III PAN AMERICANO DE ANÁLISE TÉRMICA E CALORIMETRIA, 2012, CAMPOS DO JORDÃO. VIII CONGRESSO BRASILEIRO, III PAN AMERICANO DE ANÁLISE TÉRMICA E CALORIMETRIA. Campos do Jordão, 2012. v. 1. p. 24-24.
IKEUE, K.; KAWANO, T.; ETO, M.; ZHANG, D.; MACHIDA, M. X-ray structural
study on the different redox behaviors of La and Pr oxysulfates/oxysulfides.
Journal of Alloys Compounds, 451, 338, 2008.
LLANOS, J.; SÁNCHEZ, V.; MUJICA, C.; BULJAN, A. Synthesis, physical
properties, and electronic structure of rare earths oxysulfides Ln2O2S (Ln=
Sm, Eu). Materials Research Bulletin, 379, 2285, 2002.
MACHIDA, M.; KAWAMURA, K.; ITO, K.; IKEUE, K. Large -capacity oxygen
storage by lanthanide oxysulfate/oxysulfide systems. Chemistry Materials, 17,
1487, 2005.
MACHIDA, M.; KAWANO, T.; ETO, M.; ZHANG, D.; IKEUE, K. Ln dependence
of the large-capacity oxygen storage/release property of Ln
oxysulfate/oxysulfide systems. Chemistry Materials, 19, 954, 2007.
