ÁREA: Bioquímica e Biotecnologia
TÍTULO: Produção e caracterização parcial de celulase termofílica de Bacillus sp. utilizando bagaço de cana.
AUTORES: Padilha, I.Q.M. (UFPB) ; Carvalho, L.C.T. (UFPB) ; Dias, P.V.S. (UFPB) ; Grisi, T.C.S.L. (UFPB) ; Silva, F.L.H. (UFPB) ; Santos, S.F.M. (UFPB) ; Araújo, D.A.M. (UFPB)
RESUMO: No presente estudo, foi realizada a produção e caracterização parcial de celulase
(CMCase) termofílica de Bacillus sp. C1AC5507, isolado do solo da indústria
sucroalcooleira, utilizando bagaço de cana-de-açucar. Os resultados de superfície
de resposta mostraram uma maior atividade celulolítica entre pH 4,2–5,5 e
temperatura de 67–70 oC. O modelo prevê uma máxima resposta de atividade (0,37
U/mL) em pH 4,2 e temperatura de 70 oC. A CMCase, peso molecular estimado em 55
kDa, foi fortemente estimulada por Ca+2 e Cd+2, e inibida apenas por Tween 20.
Contudo, não foi afetada por Na2+ e EDTA. A otimização do processo de produção
enzimática utilizando resíduos agroindustriais poderá contribuir para a diminuição
dos custos, bem como o aumento do valor agregado da massa lignocelolulítica.
PALAVRAS CHAVES: CMCase; Bacillus sp.; Bagaço de cana
INTRODUÇÃO: O Brasil, maior produtor de cana-de-açúcar do mundo, produziu 719 milhões de
toneladas de cana em 2010 (FAOSTAT, 2012), gerando uma enorme quantidade de
resíduo lignocelulolítico como bagaço, porém parte desse é apenas utilizado para
a co-geração de energia. O processo enzimático de hidrólise dos materiais
celulolíticos ocorre por meio da ação de várias enzimas, como as endoglucanases,
exocelobiohidrolases e ß-glicosidases (LEE et al., 2008). Desta forma, a
utilização do bagaço no processo industrial de obtenção enzimática, pode ser uma
opção viável de aplicação desse resíduo. As celulases são produzidas por uma
vasta gama de microrganismos (XU et al. 2001; WEI et al. 2006; AFZAL et al.
2010; GAUTAM et al. 2011), com uma ampla aplicação nas indústrias têxtil,
alimentícia, papel e celulose, panificação, tratamento de resíduos e de
biocombustíves (BHAT, 2000). Alguns gêneros bacterianos, como Bacillus e
Paenibacillus, possuem a capacidade de degradar tanto carboximetilcelulose (CMC)
quanto Avicel, forma cristalina da celulose (WANG et al. 2008; AFZAL et al.
2010), bem como resíduos lignocelulolíticos provenientes da agroindústria
(HARADA et al. 2005; LEE et al. 2008; LEE et al. 2010). De fato, há um esforço
na busca por novas celulases com propriedades mais adequadas para a aplicação em
processos industriais, a fim de torná-los mais eficientes e econômicos (LI et
al. 2006; LIANG et al. 2009). No presente estudo, foi realizada a produção e
caracterização parcial de celulase (CMCase) termofílica pela linhagem de
Bacillus sp., isolado do solo da indústria sucroalcooleira, utilizando bagaço de
cana-de-açúcar como fonte de carbono.
MATERIAL E MÉTODOS: Isolamento e identificação do microrganismo: a linhagem C1AC5507 foi isolada de
amostra do solo da Usina Japungu Agroindustrial, localizada em Santa Rita/PB. A
extração de DNA genômico foi realizada de acordo com método modificado de CHENG
e JIANG (2006). O gene 16S rRNA foi amplificado utilizando os primers 27F e
1525R. A sequência do amplicon foi determinada em seqüenciador automático, ABI
3100 (Applied Biosystems) e comparadas ao banco de dados (GenBank) utilizando a
ferramenta BLASTn. Produção de celulase: a produção foi realizada em frascos de
500 mL com meio contendo (g/L): bagaço de cana 10,0; NaNO3 0,5; K2HPO4 1,0;
MgSO4.7H2O 0,5; FeSO4.7H2O 0,01; extrato de levedura 1,0; em pH 7,0. O meio de
produção foi inoculado com 1% (v/v) do crescimento bacteriano e incubado a 37
ºC, 150 rpm. Após 72 h, o cultivo resultante foi centrifugado por 15 min a 9.000
rpm. O sobrenadante foi coletado e estocado a 4 ºC. Ensaios enzimáticos: a
atividade celulolítica (CMCase) foi avaliada pelo método descrito por GHOSE
(1987), assim como o efeito da temperatura (30–70 oC) e do pH (4,2–9,8) foram
estudados utilizando a metodologia do planejamento experimental fatorial mais
configuração estrela e avaliados pela superfície de resposta. O modelo do
experimento utilizado para estabelecer as condições ótimas da atividade
enzimática foi constituído por 11 ensaios, 8 combinações únicas e 3 replicações
no ponto central (Tab. 1). O efeito de cada fator e das suas interações foi
avaliado pelo método ANOVA (95% e 99%). A ação de aditivos sob a atividade
celulolítica foi avaliada com uso dos compostos: Ca+2, Cu+2, Fe+3, Mg+2, Mn+2,
Cd+2, Ni+2, Na+, EDTA, a uma concentração final de 5 mM cada e Tween 20 (0,25%).
A análise por zimograma foi realizada como descrito por GALLARDO et al. (2003).
RESULTADOS E DISCUSSÃO: Os resultados obtidos com o BLAST indicam que a sequência 16S rRNA do isolado
possui 95% de identidade com Bacillus safensis (NR041794.1), B. pumilus
(NR043242.1) e B. aerophilus (NR042339.1). Assim, devido a grande diversidade do
gênero Bacillus, a bactéria em estudo foi classificada como Bacillus sp.
C1AC5507. Os resultados da análise para os diferentes valores de pH e
temperatura estão descritos na Tabela 1. Com os dados obtidos, o modelo
estatístico prevê uma máxima resposta para atividade celulolítica de 0,37 U/mL,
em pH 4,2 e temperatura de 70 oC. A Figura 1A representa a superfície de
resposta para atividade celulolítica. A região com alta atividade está
localizada entre pH 4,2–5,5 e temperatura de 67–70 ºC. Estas características
encontrada são mais extremas que a maioria das CMCases encontradas em espécies
de Bacillus (LEE et al. 2008; YANG et al. 2010; YIN et al. 2010). Os resultados
da ANOVA indicam que o modelo polinomial obtido para atividade total tem alto
coeficiente de determinação (R2 = 0,83), mostrando bom ajuste com o modelo
obtido. A temperatura e pH mostraram efeito quadrático e linear significativo na
atividade total (p<0,05). A atividade da CMCase foi fortemente tivada por Ca+2 e
Cd+2, e moderadamente ativada por Co2+, Ni+2, Cu2+, Fe2+, Mn2+ e Mg2+.
Entretanto, a atividade enzimática não foi afetada por Na+ e EDTA, sendo inibida
apenas por Tween 20. O peso molecular da CMCase foi estimado em 55 kDa (Figura
1B), semelhante ao encontrado por LEE et al. (2008), que obtiveram uma CMCase de
B. amyloliquefaciens com aproximadamente 53 kDa. A celulase de Bacillus sp.
C1AC5507 possui um amplo potencial biotecnológico, tanto no tocante às
características da enzima quanto ao processo de produção.
Tabela 1
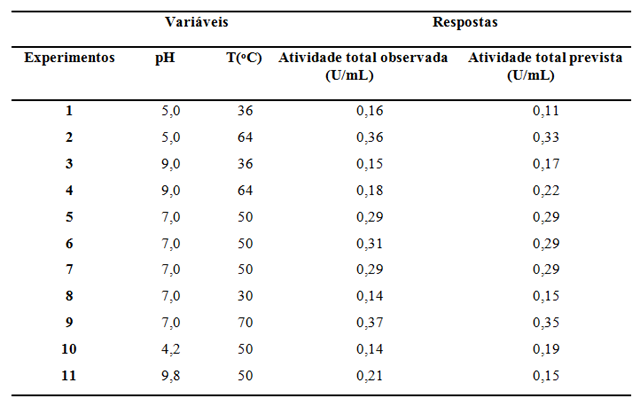
Resultados obtidos pela análise da atividade
celulolítica de Bacillus sp. C1AC5507 por meio do
planejamento experimental.
Figura 1
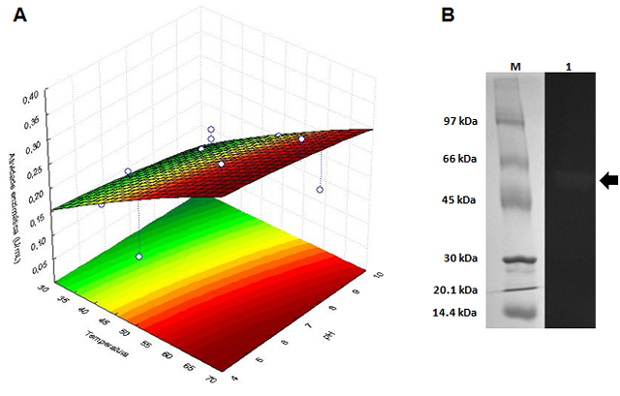
Superfície de resposta do efeito do pH e da
temperatura sob a atividade enzimática (A) e
zimograma (B, coluna 1) de Bacillus sp. C1AC5507.
CONCLUSÕES: A busca por celulases termofílicas, a exemplo da encontrada neste trabalho, e a
otimização do processo de produção enzimática utilizando resíduos agroindustriais
poderá contribuir para a diminuição dos custos, bem como o aumento do valor
agregado da massa lignocelolulítica.
AGRADECIMENTOS: Os autores agradecem a colaboração da Dra. Krystyna Gorlach Lira (UFPB). O
trabalho teve o suporte financeiro das agências: CNPq e CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: AFZAL, S.; SALEEM, M.; YASMIN, R.; NAZ, M.; IMRAN, M. 2010. Pre and post cloning characterization of a beta-1,4-endoglucanase from Bacillus sp. Molecular Biology Reports, 37:1717-23.
BHAT, M.K. 2000. Cellulases and related enzymes in biotechnology. Biotechnology Advances, 18:355-383.
CHENG, H.R.; JIANG, N. 2006. Extremely rapid extraction of DNA from bacteria and yeasts. Biotechnol Letters, 28:55-9.
GALLARDO, O.; DIAZ, P.; PASTOR, F.I. 2003. Characterization of a Paenibacillus cell-associated xylanase with high activity on aryl-xylosides: a new subclass of family 10 xylanases. Applied Microbiology and Biotechnology, 61:226-33.
GAUTAM, S.P.; BUNDELA, P.S.; PANDEY, A.K.; KHAN, J.; AWASTHI, M.K.; SARSAIYA, S. 2011. Optimization for the production of cellulase enzyme from municipal solid waste residue by two novel cellulolytic fungi. Biotechnology Research International, 810425.
GHOSE, T.K. 1987. Measurement of cellulase activities. Pure & Applied Chemistry, 59:257-268.
HARADA, K.M.; TANAKA, K.; FUKUDA, Y.; HASHIMOTO, W.; MURATA, K. 2005. Degradation of rice bran hemicellulose by Paenibacillus sp. strain HC1: gene cloning, characterization and function of beta-D-glucosidase as an enzyme involved in degradation. Archives of Microbiology, 184:215-24.
LEE, B.H.; KIM, B.K.; LEE, Y.J.; CHUNG, C.H.; LEE, J.W. 2010. Industrial scale of optimization for the production of carboxymethylcellulase from rice bran by a marine bacterium, Bacillus subtilis subsp subtilis A-53. Enzyme and Microbial Technology, 46:38-42.
LEE, Y.J.; KIM, B.K.; LEE, B.H.; JO, K.I.; LEE, N.K.; CHUNG, C.H.; LEE, Y.C.; LEE, J.W. 2008. Purification and characterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull. Bioresource Technology, 378-86.
LI, Y.H.; DING, M.; WANG, J.; XU, G.J.; ZHAO, F. 2006. A novel thermoacidophilic endoglucanase, Ba-EGA, from a new cellulose-degrading bacterium, Bacillus sp.AC-1. Applied Microbiology and Biotechnology, 70:430-6.
LIANG, Y.; YESUF, J.; SCHMITT, S.; BENDER, K.; BOZZOLA, J. 2009. Study of cellulases from a newly isolated thermophilic and cellulolytic Brevibacillus sp. strain JXL. Journal of Industrial Microbiology and Biotechnology, 36:961-70.
WANG, C.M.; SHYU, C.L.; HO, S.P.; CHIOU, S.H. 2008. Characterization of a novel thermophilic, cellulose-degrading bacterium Paenibacillus sp. strain B39. Letters in Applied Microbiology, 47:46-53.
WEI, Y.D.; LEE, K.S.; GUI, Z.Z.; YOON, H.J.; KIM, I.; ZHANG, G.Z.; GUO, X.; SOHN, H.D.; JIN, B.R. 2006. Molecular cloning, expression, and enzymatic activity of a novel endogenous cellulase from the mulberry longicorn beetle, Apriona germari. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 145:220-9.
XU, B.; JANSON, J.C.; SELLOS, D. 2001. Cloning and sequencing of a molluscan endo-beta-1,4-glucanase gene from the blue mussel, Mytilus edulis. European Journal of Biochemistry, 268:3718-27.
YANG, D.; WENG, H.; WANG, M.; XU, W.; LI, Y.; YANG, H. 2010. Cloning and expression of a novel thermostable cellulase from newly isolated Bacillus subtilis strain I15. Molecular Biology Reports, 37:1923-1929.
YIN, L.J.; LIN, H.H.; XIAO, Z.R. 2010. Purification and characterization of a cellulase from Bacillus subtilis YJ1. Journal of Marine Science and Technology-Taiwan, 18:466-471.
