ÁREA: Bioquímica e Biotecnologia
TÍTULO: Produção de lipases por bactérias isoladas de um solo contaminado com óleo vegetal residual
AUTORES: Carvalho, L.C.T. (UFPB) ; Dias, P.V.S. (UFPB) ; Gorlach-lira, K. (UFPB)
RESUMO: Neste trabalho foi analisada a produção de lipases por bactérias isoladas de um
solo contaminado com óleo vegetal residual. Das 66 linhagens isoladas, todas
demonstraram atividade lipolítica no meio ágar tributirina. No meio ágar
rodamina B com azeite de oliva, 25 linhagens foram positivas, com atividade
lipolítica de 0,62 a 12,4 U/mL. Os resultados da superfície de resposta da
linhagem Burkholderia sp. O19 mostraram uma maior atividade lipolítica em pH
7,5–9,0 e temperatura de 45–70 oC. O modelo prevê uma máxima resposta de
atividade (19,04 U/mL) em pH 8,5 e temperatura de 65 oC. Os resultados deste
estudo demonstram que as lipases produzidas pelas bactérias isoladas do solo
contaminado com óleo vegetal residual apresentam potencial aplicação em
processos industriais e de biorremediação.
PALAVRAS CHAVES: Solo; Bactérias; Lipases
INTRODUÇÃO: A presença de populações microbianas no solo possibilita a degradação tanto de
compostos orgânicos como de produtos xenobióticos recalcitrantes. A eliminação
de resíduos como óleos, sebos e gorduras, gerados pela indústria, tem se tornado
um problema ambiental crescente. Isto tem aumentado o interesse pela prospecção
de microrganismos como fontes de enzimas específicas para processos de
biorremediação e biotecnologia industrial (CAMEOTRA; MAKKAR, 1998; HOSTER et
al., 2004).
Dentre as enzimas mais visadas atualmente, destacam-se as lipases, as quais
pertencem à classe das hidrolases (E.C.3.1) e atuam catalisando a hidrólise de
ligações éster-carboxílicas de acilgliceróis para liberar ácidos graxos e
glicerol, sendo conhecidas como triacilglicerol acil hidrolases (E.C.3.1.1.3)
(SHARMA et al., 2001).
As lipases microbianas são mais visadas que aquelas de origem vegetal e animal
por apresentarem boa estabilidade, alta conversão de substrato em produto, ampla
faixa de atuação em diferentes temperaturas e pHs, e por serem produzidas, em
sua grande maioria, extracelularmente, facilitando assim sua obtenção (HASAN et
al., 2006; HORSHANI et al., 2009).
O processo de obtenção das lipases envolve numerosas variáveis que vão desde a
composição do meio (fontes de carbono e nitrogênio) até as condições
operacionais como pH, temperatura e agitação (BURKERT et al., 2003; KUMAR et
al., 2005. Desta forma, o objetivo deste trabalho foi isolar linhagens
bacterianas de um solo contaminado com óleo vegetal residual, analisar
(qualitativamente e quantitativamente) a atividade lipolítica das mesmas e
avaliar as melhores condições de pH e temperatura para se obter uma máxima
atividade lipolítica, através da Metodologia de Superfície de Resposta.
MATERIAL E MÉTODOS: Área de estudo: A amostra de solo foi coletada em uma área utilizada para
descarte de óleo vegetal residual, localizada em João Pessoa-PB (7°12'9,5" S -
34°48'21,8" O), em novembro de 2010.
Processamento do solo e isolamento bacteriano: diluições decimais seriais da
amostra foram adicionadas a meios de cultivo específicos. As placas foram
incubadas a 30 oC e, posteriormente, as bactérias foram isoladas.
Análise qualitativa da atividade lipolítica: As linhagens foram incubadas no
meio ágar tributirina para análise da hidrólise da tributirina. As linhagens
positivas, que apresentaram um halo transparente ao redor da colônia, foram
incubadas no meio ágar rodamina B com azeite de oliva (1%). A hidrólise do
azeite pelas linhagens foi evidenciada pela formação de um halo alaranjado ao
redor da colônia.
Análise quantitativa da atividade lipolítica: as linhagens lipolíticas no meio
ágar rodamina B com azeite de oliva, foram cultivadas no meio caldo nutriente
com azeite de oliva (1%) e incubadas por 48 horas (150 rpm; 30 oC). O
sobrenadante obtido por centrifugação foi utilizado para determinar a atividade
lipolítica por titulometria, através do método proposto por Stuer et al. (1986).
Efeito do pH e da temperatura sobre a atividade lipolítica através da
Metodologia de Superfície de Resposta: a linhagem O19, caracterizada como
Burkholderia sp. (dados não mostrados), foi avaliada quanto as condições ótimas
de pH (7,0–10,0) e temperatura (30oC–70oC) para atividade lipolítica. O
experimento consistiu em 11 ensaios, 8 combinações únicas e 3 replicações no
ponto central (Tabela 01). O efeito de cada fator e das suas interações foi
avaliado pelo método ANOVA (95% e 99%).
RESULTADOS E DISCUSSÃO: Das 66 linhagens bacterianas isoladas, todas apresentaram atividade lipolítica
no meio ágar tributirina. No meio ágar rodamina B com azeite de oliva, apenas 25
linhagens foram positivas. Segundo Kim (2001), o teste com azeite de oliva e
rodamina B é mais recomendado para identificar bactérias lipolíticas, uma vez
que tanto esterases como lipases podem hidrolisar a tributirina.
O azeite de oliva vem sendo amplamente utilizado como indutor de lipases devido
à alta quantidade de ácido oléico em sua composição, sendo este considerado, em
estudos de Gordilho et al. (1998) e Motensinos et al. (1996) o melhor indutor
para a produção de lipases.
Das 25 linhagens positivas no meio ágar rodamina B, as que apresentaram maior
atividade lipolítica foram O19, O17 e O45, com 12,4 U/mL/min, 10,7 U/mL/min e
10,5 U/mL/min, respectivamente.
A linhagem Burkholderia sp. O19, que apresentou uma maior atividade lipolítica,
foi avaliada quanto as melhores condições de pH (7,0 – 10,0) e temperatura (30
– 70 oC) (Tabela 1). A Figura 1 representa a superfície de resposta para
atividade lipolítica total da linhagem testada. A região com alta atividade
lipolítica está localizada na faixa entre 7,5 - 9,0 (pH) e 45 – 70oC
(temperatura). O modelo prevê uma máxima resposta para atividade lipolítica
(19.04 U/ml) no pH 8,5 e temperatura de 65 oC (Figura 1), semelhante ao
encontrado por Liu et al. (2006), ao utilizar a metodologia de superfície de
resposta, onde a maior produção de lipases por Burkholderia sp. C20 foi prevista
para o pH 9,0 e a temperatura de 55oC.
Os nossos resultados apresentaram alto coeficiente de determinação (R2 = 0,91),
demonstrando bom ajuste com o modelo obtido. A temperatura e o pH mostraram
efeito quadrático e linear significante na atividade total (p < 0,05).
Tabela 1 - Resultados obtidos pela análise da atividade lipolítica tot
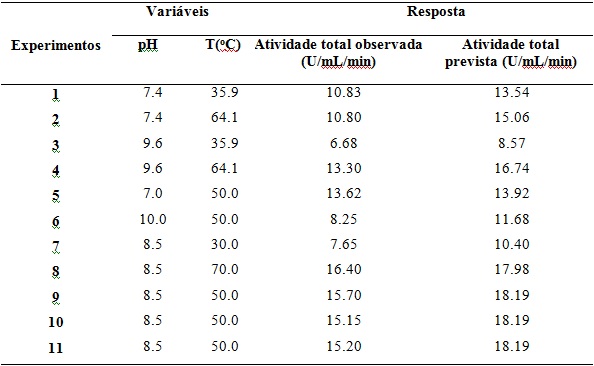
Figura 1 - Superfície de resposta do efeito do pH e da temperatura sob

CONCLUSÕES: Os resultados deste estudo demonstram que as lipases produzidas pelas bactérias
isoladas do solo contaminado com óleo vegetal residual apresentam potencial
aplicação em processos industriais e de biorremediação. Outros estudos estão em
andamento para purificar estas enzimas e melhorar sua produção utilizando
substratos alternativos, como resíduos de petróleo.
AGRADECIMENTOS: Os autores agradecem o suporte financeiro do CNPq e CAPES.
REFERÊNCIAS BIBLIOGRÁFICA: CAMEOTRA, S.S.; MAKKAR, R.S. Synthesis of biosurfactants in extreme conditions. Applied Microbiology and Biotechnology, v.50, p.520–529, 1998.
GORDILHO, M.A.; MONTESINOS, J.L.; CASAS, C.; VALERO, F.; LAFUENTE, J.; SOLÁ, C. Improving lipase production from Candida rugosa by a biochemical engineering approach. Chemistry and Physics Lipids, v. 93, p. 131-142, 1998.
HOSTER, F., SCHMITZ, J.E., DANIEL, R. Enrichment of chitinolytic microorganisms: isolation and characterization of a chitinase exhibiting antifungal activity against phytopathogenic fungi from a novel Streptomyces strain. Applied Microbiology Biotechnology, v.66, p.434–442, 2004.
KIM, E. K.; JANG, W. H.; KO, J. H.; KANG, J. S.; NOH, M. J.; YOO, O. J. Lipase and Its Modulator from Pseudomonas sp. Strain KFCC 10818: Proline-to-Glutamine Substitution at Position 112 Induces Formation of Enzymatically Active Lipase in the Absence of the Modulator. Journal of Bacteriology, v.183, n.20, p.5937-5941, 2001.
LIU, C.-H.; LU, W.-B.; CHANG, J.-S. Optimizing lipase production of Burkholderia sp. by response surface methodology. Process Biochemistry, v.41, p.1940–1944, 2006.
MONTESINOS, J.L.; OSBRADORS, N.; GORDILLO, M.A.; VALERO, F.; LAFUENTE, J.; SOLÀ, C. Effect of nitrogen sources in batch and continuous cultures to lipase production by Candida rugosa. Applied Biochemistry and Biotechnology, v. 59, p. 25-37, 1996.
SHARMA, R.; CHISTI, Y.; BANERJEE, U.C. Production, purification, characterization, and applications of lipases. Biotechnology Advances, v.19, p.627-662, 2001.
SHARMA, D.; SHARMA, B. SHUKLA, A.K. Biotechnological approach of microbial lipase: a review. Biotechnology, v.10, n.1, p.23-40, 2011.
STUER, W.; JAEGER, K. E.; WINKLER, U. K. Purification of extracellular lipase from Pseudomonas aeruginosa. Journal of Bacteriology, v. 168, p.1070-1074, 1986.
