ÁREA: Alimentos
TÍTULO: Extração simultânea de deoxinivalenol (DON), nivalenol (NIV) e zearalenona (ZEA) a partir de cultivo microbiano
AUTORES: Manetti, K. (FURG) ; Nora, N. (FURG) ; Heidtmann-bemvenuti, R. (FURG) ; Badiale-furlong, E. (FURG)
RESUMO: Neste trabalho foi estabelecido um procedimento de extração simultânea das
micotoxinas DON, NIV e ZEA a partir de cultivo microbiano. Placas de petri foram
fortificadas com as micotoxinas e foram utilizados seis métodos para a extração
das mesmas, sendo que suas diferenças eram com relação à matriz alvo e a
quantidade de solvente e sais utilizados. A detecção e quantificação foram
realizadas por cromatografia de camada delgada de alta eficiência através de um
procedimento fotométrico. O método que apresentou maior recuperação das
micotoxinas estudadas foi melhorado através de um planejamento fatorial 22. O
método melhorado mostrou 79,5%, 67,0% e 79,7% de recuperação para NIV, DON e ZEA,
respectivamente.
PALAVRAS CHAVES: micotoxinas; recuperação; planejamento fatorial
INTRODUÇÃO: As micotoxinas provêm do metabolismo secundário de fungos toxigênicos e possuem
algumas características como: amplo espectro de toxicidade, baixo peso
molecular, termoestabilidade e atuação em baixas concentrações. O estresse, o
desbalanço de nutrientes e as condições ambientais promovem a produção desses
metabólitos pelas espécies toxigênicas (BOK et al., 2004).
Vários métodos podem ser utilizados para detecção e quantificação de
micotoxinas, os quais se destacam os cromatográficos tais como, cromatografia em
camada delgada (CCD), cromatografia líquida de alta resolução (HPLC) e
cromatografia gasosa (GC) (SALEM e AHMAD 2010; TURNER et al., 2009). O método
mais usado para determinação de micotoxinas é o HPLC devido a sua sensitividade
e precisão (GILBERT & ANKLAM, 2002), sendo, porém, uma técnica de elevado custo
inicial. Em contraste, a CCD é uma técnica simples, relativamente de baixo custo
e que pode, se bem conduzida, ser muito útil para padronização de etapas de
extração e limpeza de extrato. Para melhorar o desempenho quantitativo das
técnicas de CCD foi desenvolvido por Hoeltz et al., (2010) um procedimento que
utiliza imagens fluorescentes obtidas de lâmpada UV na etapa de identificação e
quantificação das amostras em placas CCD.
Vários métodos são encontrados na literatura para extração de micotoxinas de
matrizes como arroz, milho entre outras com parâmetros de desempenho de acordo
com órgãos oficiais (HEIDTMANN-BEMVENUTI et al., 2012; PINTO et al., 2007).
Porém são se tem muita informação sobre métodos de extração de micotoxinas de
meio de cultura, importante no caso de estudos in vitro.
Este trabalho teve por objetivo obter um método de extração simultânea de DON,
NIV e ZEA de meio de cultura.
MATERIAL E MÉTODOS: As placas de petri contendo 15 mL de meio ágar batata dextrose foram
fortificadas com as micotoxinas em nível 3 vezes superior ao limite de detecção
previamente determinado em CCD (0,219 µg para DON, 0,150 µg para NIV e 0,229 µg
para ZEA). Após 24 horas, foi realizada a extração por seis métodos que diferiam
com relação à matriz alvo e a quantidade de solvente e sais utilizados. O 1º
método utilizado era de Monaci et al., (2011), o 2º de Zachariasova et al.,
(2010), o 3º de Vaclavik et al., (2010), o 4º de Sospedra et al., (2010), o 5º
de Nielsen e Smedsgaard (2003) e o 6º de Heidtmann-Bemvenuti et al., (2012).
A detecção e quantificação foi realizada utilizando CCD através de um
procedimento fotométrico desenvolvido por Hoeltz et al., (2010), onde a cuba de
eluição continha tolueno:acetato de etila:ácido fórmico (30:20:5). A placa de
CCD foi revelada com AlCl3 15% e levada à estufa a 130°C por 10 min. Após, as
placas foram colocadas na câmera sob luz ultravioleta (364 nm) e alinhadas na
resolução ótima da imagem para serem fotografadas e posteriormente analisadas
usando package ImageJ.
Sendo o 3º método o que proporcionou a maior recuperação para as micotoxinas,
este foi melhorado através de um planejamento fatorial 22 usando agitador
orbital e vortex. O método consistiu em pesar 2 g de amostra, adicionar água
destilada e acetonitrila, levar ao vortex por 4 min (ou agitador por 20 min),
adicionar os sais (MgSO4 e NaCl), levar ao vortex por 3 min (ou agitador por 15
min) e centrifugar (5 min, 3220 g, 20°C). Após, recolher uma alíquota de 4 mL da
fase orgânica para um frasco e secar. As variáveis testadas no planejamento
foram acetonitrila:água nos níveis 1 (12,5:7,5 mL), 0 (10:10 mL) e -1 (7,5:12,5
mL) e MgSO4:NaCl nos níveis 1 (4:1 g), 0 (2,5:2,5 g) e -1 (1:4 g).
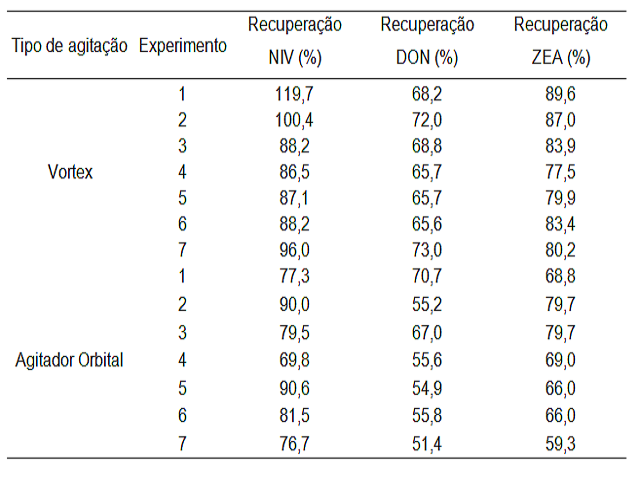
RESULTADOS E DISCUSSÃO: Durante a observação da placa de CCD, o único método que propiciou a detecção
das 3 micotoxinas estudadas foi referente ao terceiro método (Vaclavik et al.,
(2010). Por esse motivo, tal método foi submetido a um planejamento fatorial 22,
usando vortex e agitador orbital para otimizar sua recuperação.
De acordo com o CEN - EUROPEAN COMMITTEE FOR STANDARTIZATION, as micotoxinas
devem apresentar recuperação entre 60 e 120%. Os resultados mostram que (Tabela
2) para ZEA e NIV todas as condições propiciaram recuperação de acordo com o
recomendado. No entanto o DON apresentou recuperação inferior aos limites em
35,7% dos experimentos. Este fato é atribuído a saturação do solvente pelas
demais micotoxinas em estudo. Recuperação maior que 100% foi verificada para NIV
nos experimentos 1 e 2, possivelmente pela presença de interferentes presentes
na detecção da imagem.
O experimento 3, usando extração com agitação orbital, apresentou uma
recuperação de NIV e ZEA de 79,5 e 79,7%, respectivamente, e de DON dentro dos
limites aceitáveis para confiabilidade (67%). Além disso, neste experimento as
condições de agitação propiciaram redução do tempo de análise. Nele as
proporções dos solventes (acetonitrila:água (mL) 7,5:12,5) e dos sais
(MgSO4:NaCl (g) 4:1) recomendadas para a extração de DON, NIV e ZEA a partir do
cultivo também podem ser consideradas interessantes para reduzir a geração de
resíduos.
Recuperação em CCD para DON, NIV e ZEA.
CONCLUSÕES: Foi possível obter um método de extração simultânea de DON, NIV e ZEA a partir de
cultivos microbianos com indicativo de mérito recomendado para os níveis de
recuperação. O método melhorado mostrou 79,5%, 67,0% e 79,7% de recuperação para
NIV, DON e ZEA,
respectivamente.
AGRADECIMENTOS: Agradecemos ao CNPq e a CAPES pelo auxílio financeiro cedido.
REFERÊNCIAS BIBLIOGRÁFICA: BOK, J. W.; KELLER, N. P.; LAE, A. A regulator of secondary metabolism in Aspergillus spp. Eukaryotic Cell. v. 3, p. 527-535, 2004.
CEN – EUROPEAN COMMITTEE FOR STANDARTISATION. CEN Repot: Food Analysis – Biotoxins: Criteria of analytical methods for mycotoxins, Brussels. CR 13505:199E. 8 p.
GILBERT, J.; ANKLAM, E. Validation of analytical methods fordetermining mycotoxins in foodstuffs. Trends Anal. Chem. 2002,21, 468-486.
HEIDTMANN-BEMVENUTI, R.; HACKBART, H. C. S.; SOUZA, M. M.; BADIALE-FURLONG, E.; DORS, G. C.; FAGUNDES, C. A. Determinação de deoxinivalenol e zearalenona em arroz natural e parboilizado e suas frações utilizando QuEChERS E HPLC/UV-FL. Química Nova. v. XY, n. 00, p. 1-6, 2012.
HOELTZ, M.; WELKE, J. E.; NOLL, I. B.; DOTTORI, H. A. Photometric procedure for quantitative analysis of aflatoxin b1 in peanuts by thin-layer chromatography using charge coupled device detector. Química Nova. n. 1, v. 33, p. 43-47, 2010.
PINTO, N. F. J. A.; VARGAS, E. A.; PREIS, R. A. Qualidade sanitária e produção de fumonisina B1 em grãos de milho na fase de pré-colheita. Summa Phytopathologica, v.33, n.3, p.304-306, 2007.
SALEM, N. M.; AHMAD, R. Mycotoxins in food from Jordan: Preliminary survey. Food Control. n. 21, p. 1099–1103, 2010.
TURNER, N. W.; SUBRAHMANYAMB, S.; PILETSKY, S. A. Analytical methods for determination of mycotoxins: A review. Analytica Chimica Acta. v. 632, p.168–180, 2009.
