ÁREA: Química Analítica
TÍTULO: DETERMINAÇÃO DE Mn2+ APÓS A ADSORÇÃO EM QUITOSANA POR VOLTAMETRIA DE ONDA QUADRADA
AUTORES: SANTOS, E.V. (UFRN) ; BELARMINO, L.D. (UFRN) ; MARTÍNEZ-HUITLE, C.A. (UFRN) ; FERNANDES, N.S. (UFRN)
RESUMO: A quitosana origina-se da desacetilação parcial da quitina e tem uma grande aplicação
como agente complexante na remoção de metais como também, na área farmacêutica e na
indústria alimentícia. Neste trabalho, o objetivo principal foi analisar a capacidade
de remoção dos íons Mn2+ usando a quitosana como adsorvente e realizar a quantificação
dos íons adsorvidos por meio da voltametria de onda quadrada por redissolução catódica.
Os resultados indicaram que a adsorção dos íons Mn2+ na quitosana foram de 10,34% e
42,12% nos tempos de 5 e 30 minutos, respectivamente, utilizando uma concentração
inicial da solução de 10 mgL-1.
PALAVRAS CHAVES: quitosana, manganês, voltametria de redissolução
INTRODUÇÃO: A principal aplicação do manganês é como desoxidante na produção de ferro e aço.
Portanto, com esta finalidade, o metal é usado na forma de sua liga com ferro,
conhecida como ferromanganês. Com o avanço industrial e a busca pela minimização dos
impactos ambientais ocasionados pelo excesso de metais em águas, surgem estudos na
utilização de diversos adsorventes tais como: argilas naturais, serragem, bentonita,
zeólita, perlita e quitosana. Algumas técnicas utilizadas para a remoção são
precipitação química, ultrafiltração, flotação, resinas de troca iônica, utilização
de matéria orgânica morta e adsorção. No Brasil a resolução em vigor para controle de
efluentes é a 357 de 17 de março de 2005 do CONAMA (Conselho Nacional do Meio
Ambiente) que limita o teor de manganês em 0,1 mgL-1, sendo padrão para água doce. A
quitosana foi utilizada neste trabalho como adsorvente na remoção de íons Mn em
soluções sintéticas e após o processo de adsorção foi quantificado através da
voltametria de onda quadrada por redissolução catódica.
MATERIAL E MÉTODOS: A quitosana foi sintetizada no Laboratório de Síntese Orgânica do Departamento de
Química da UFRN obtendo-se um grau de desacetilação correspondente a 92%. A solução
estoque com concentração de 100 mgL-1 (5,59×10-4 molL-1 de Mn2+) foi preparada com
água dezionizada utilizando Mn(NO3)2.4H2O da VETEC . A solução de trabalho de Mn (II)
foi obtida por diluição da solução estoque em água dezionizada. A adsorção foi
realizada com a massa de 150 mg de quitosana em 100mL de solução de Mn2+ com
concentração de 10 mgL-1 e agitação de 110 rpm. Foi utilizado um erlenmeyer de 250 mL
e tempo de contato de 30 min. A adsorção foi realizada a temperatura de (25,0 ±
1,0°C) e o pH da solução foi medido com pHmetro modelo Toledo sendo de 6,1. Alíquotas
de 5 mL do adsorbato foram retiradas a cada 5 min para centrifugação por 15 min para
evitar a presença de material em suspensão durante a análise. As medidas
voltamétricas foram realizadas em um Potenciostato/Galvanostato modelo PGSTAT 302N da
Autolab/Eco Chemie e monitorado pelo software GPES 4.9. Os estudos voltamétricos
foram realizados em uma célula eletroquímica com capacidade para 50 mL, contendo um
eletrodo de trabalho de carbono vítreo, um eletrodo de referência de prata/cloreto de
prata e um eletrodo auxiliar de platina. Inicialmente, estudos de otimização dos
parâmetros operacionais dessa técnica foram realizados, como tempo de duração do
pulso (tp), amplitude de potencial de pulso aplicado (DEp) e velocidade de varredura
(v). As condições ideais obtidas para estes parâmetros foram: tp = 30 s; Dep 1,2 V e
v = 10 mV s-1, tempo de condicionamento para aplicação do potencial de 5 s, tempo de
equilíbrio: 10 s para os íons Mn2+. A solução tampão foi preparada com o
Na2HPO4/NaH2PO4 pH 4, ajustando o pH com H3PO4 0,1 mol/L e NaOH 0,1 mol/
RESULTADOS E DISCUSSÃO: Para a determinação dos íons Mn2+ foi necessário a preparação de curvas analíticas
utilizando a voltametria de onda quadrada de redissolução em um sistema tampão
(Na2HPO4/NaH2PO4) 0,1 molL-1 variando o pH com as soluções de H3PO4 0,1 molL-1 e NaOH
0,1 molL-1 para a obtenção da melhor faixa de trabalho.
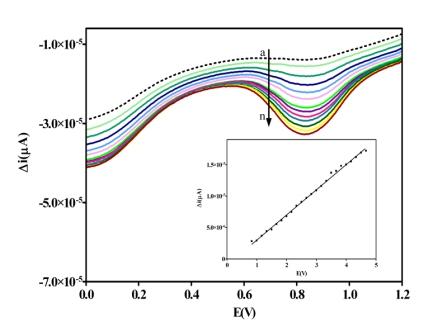
Para a quantificação dos íons Mn2+, o pH foi ajustado em 4 e foi adicionado de 200 a
1500µL da solução de Mn2+ com concentração de 10mgL-1, apresentando um pico catódico
em 0,873 V (Figura 1) com limite de detecção de 0,1667 mgL-1 de Mn2+ (7,76x10-7
mol/L).
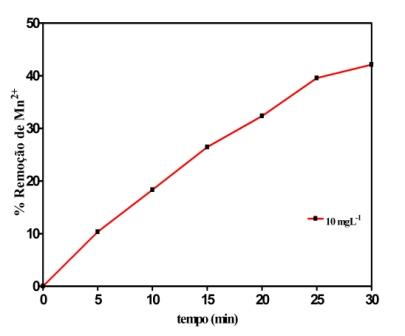
Os resultados da adsorção da quitosana após o contato com os íons Mn2+ nos primeiros
5 minutos indicaram a remoção de 10,34% de íons Mn2+ presentes na solução com
concentração inicial de 10 mgL-1 e em 30 min de 42,12%, como mostra a Figura 2.
Conforme pode ser observado em 30 minutos, o tempo de equilíbrio para adsorção dos
íons Mn2+ não foi alcançado.
CONCLUSÕES: A quitosana nos primeiros 5 min adsorveu 30 minutos de contato com as soluções contendo
íons Mn2+ de concentração 10mgL-1, adsorveu 42,12%, se mostrando como um potencial
adsorvente na remoção de metais em efluentes que contenham íons Mn2+.
A voltametria de onda quadrada por redissolução catódica apresentou reprodutibilidade
nos resultados, limite de detecção de 7,76x10-7 mol/L (Mn2+) e baixo custo analítico.
AGRADECIMENTOS: CAPES, PETROBRAS, IQ-UFRN E NUPPRAR/UFRN.
REFERÊNCIAS BIBLIOGRÁFICA: ALBERTINI,S.; CARMO, L.F.; FILHO, L.G.P. Utilização de serragem e bagaço de cana-de-açucar para adsorção de cádmio. Ciências Tecnológicas de Alimentos Campinas. n°1, v.27, p. 113-118, 2007.
ARAUJO,A.L.P. et al. Estudo termodinâmico da adsorção de Zinco em argila bentonita bofe calcinada. n° 12, V. 5, p.1-6, 2009.
BECKER, T., SCHLAAK, M., STRASDEIT, H., Adsorption of nickel(II), zinc (II) and cadmium(II) by new chitosan derivates. Reactive & Functional Polymers. 44, 289-298. 2000.
CONAMA: Conselho Nacional de Meio Ambiente Disponível em: http://www.mma.gov.br/port/conama: Acesso em 29 de jun. 2011.
OLGA M.S. F., CHRISTOPHER M.A.B. Cathodic stripping voltammetry of trace Mn(II) at carbon film electrodes. Talanta. 2003, 61,643-650.
ROITZ, J.S., BRULAND, K.W. Determination of dissolved manganese (II) in coastal and estuarine waters by differential pulse cathodic stripping voltammetry. Analytica Chimica Acta, 344, 1997.
TALIP,Z.; ERAL, M.; HIÇSONMEZ,U. Adsorption of thorium from aqueous solutions by perlite.Journal of Environmental Radioactivity. v. 100, p. 139-143, 2009.
