ÁREA: Alimentos
TÍTULO: AVALIAÇÃO DA QUALIDADE MICROBIOLÓGICA DE AMOSTRAS DO MEL DE MELIPONA COMPRESSIPES E APIS MELLIFERA DO ESTADO DO MARANHÃO
AUTORES: SALES, D.P. (UEMA) ; SOUSA, P.B. (UEMA) ; BRITO, L.B.S. (UEMA) ; A, L.M.C. (UEMA) ; BEZERRA, M. (UEMA)
RESUMO: A apicultura é uma das atividades que beneficia tanto a natureza quanto o ser humano.O mel é considerado o produto apícola de maior comercialização,pelo fato de ser mais fácil de ser explorado e o mais conhecido.Sendo assim,este estudo teve como objetivo analisar a qualidade microbiológica do mel produzido no Estado do Maranhão,quanto à presença de coliformes totais,termotolerantes,bolores e leveduras.Foram analisadas 12 amostras de mel.De acordo com os resultados obtidos para contagem padrão de bolores e leveduras,3 amostras,apresentaram valores acima do máximo estabelecido pela regulamentação técnica para alimentos.Das 12 amostras,apenas duas foi registrada a presença de coliformes a 35ºC e 45ºC foi maior que 3,0 NMP g-1,sugerindo uma observância às boas práticas de manipulação do mel.
PALAVRAS CHAVES: mel. coliformes. bolores.
INTRODUÇÃO: A apicultura possui a abelha que possui as características de ser um excelente polinizador,ocasionando conseqüentemente uma variabilidade genética das espécies, favorecendo,deste modo,todo o ecossistema.O ser humano é beneficiado com os produtos por ela produzidos.Segundo SOMMER (1996) e PEREZ (2005,p.34) o Brasil é 5º maior produtor de mel(Estados Unidos,Argentina,México e Canadá).No Maranhão a produção e comercialização de mel têm sido colocadas como uma das áreas estratégicas de interesse do Estado para promover o desenvolvimento da agricultura familiar.As floradas silvestres,favorecem o Estado para ser um grande pólo de produção de mel.Dentre as espécies de abelhas produtoras dos principais méis comercializados no Estado do Maranhão,destacam-se a Melipona compressipes e a Apis mellifera (SILVA, A.C;BRINGEL,J.M.M. 2006,p 57).A contaminação microbiológica pode ser causada pela microbiota da própria Apis mellifera (DUARTE et. al.,2006,p.69),ou estes podem ser introduzidos no mel pela própria abelha ou pela falta de higiene na extração e beneficiamento,onde a comercialização dos produtos podem apresentar pólen,néctar floral,poeira,terra e o próprio corpo e trato digestivo da abelha,além de fungos e algumas bactérias (SNOWDON et. al.,1996, p. 31).Como a apicultura é uma atividade que vem crescendo gradualmente,no entanto,é necessário estar informado da procedência do produto,se há fiscalização e se este se encontra nos padrões de higiene exigidos pelo Ministério da Agricultura.Dessa forma,este estudo tem como objetivo geral analisar a qualidade microbiológica de amostras de mel de Tiúba e Apis Mellifera comercializadas no Estado do Maranhão.São objetivos específicos pesquisar a presença de coliformes termotolerantes e enumerar a presença de fungos, bolores e leveduras.
MATERIAL E MÉTODOS: Foram utilizadas 12 amostras de mel,sendo 9 da abelha Melipona compressipes e 3 da Apis mellifera adquiridas direto do produtor de diferentes localidades do Estado do Maranhão,em seguida as amostras foram levadas para realização das análises no Laboratório de Microbiologia de Água e Alimentos da Universidade Estadual do Maranhão (UEMA),onde foram realizadas as análises microbiológicas,por meio dos métodos recomendados pela Associação Americana de Saúde Pública(APHA),como pesquisa de coliformes totais e termotolerantes,utilizando a técnica do Número Mais Provável (NMP),(HITCHINS 1992,325-69;PEELER 1992,105-20 p.),e contagem de bolores e leveduras (SILVA,1997,p.99).Uma alíquota de 25,0 g das amostras de mel foi tomada para preparação da primeira diluição (10–1) em 225,0 mL de água peptonada tamponada 0,1%,e as preparações das diluições decimais subsequentes foram realizadas em tubos contendo 9,0 mL do mesmo diluente para obtenção das concentrações 10–2 e 10–3 de mel.Para contagem padrão dos bolores e leveduras,1,0 mL das diluições foi plaqueado em profundidade,utilizando o meio Ágar Batata Dextrose (BDA).A incubação se deu em estufa bacteriológica a 25 °C durante 5 dias.Após esse período,as placas foram contadas para determinar o número de unidades formadoras de colônia (UFC.g–1).Para a pesquisa de coliformes,foi utilizada a técnica de fermentação em tubos múltiplos,sendo inicialmente realizado o teste presuntivo utilizando o caldo lauril sulfato triptose (LST) para incubação das diluições,permanecendo este material em estufa para demanda biológica de oxigênio (BOD) a 35 °C por 48 horas.Para os tubos com resultados positivos,foi realizado o teste confirmatório utilizando o caldo verde bile brilhante (VBB) para coliformes a 35 °C e o caldo Escherichia coli (EC)para 45°C.
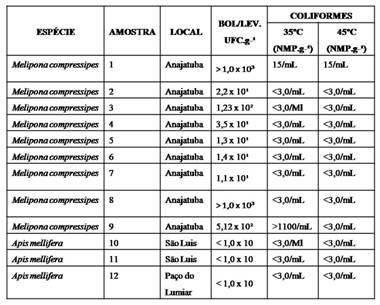
RESULTADOS E DISCUSSÃO: Os resultados encontrados para as contagens padrão de bolores e leveduras (UFC.g–1),número mais provável de coliformes a 35 °C e a 45 °C (NMP.g–1),são apresentados na Tabela 1.De acordo com os resultados obtidos para contagem padrão de bolores e leveduras, 3 amostras, correspondendo a 36% do total, apresentaram valores acima do máximo estabelecido pela regulamentação técnica para alimentos, RDC 012 (BRASIL, 2001, p.29), sendo consideradas impróprias para o consumo humano direto. Os valores máximo e mínimo foram < 1,0 x 10,4 × 103 UFC.g–1.Conforme a tabela 1, das 12 amostras, apenas duas foi registrada a presença de coliformes a 35ºC e 45ºC foi maior que 3,0 NMP g-1, sugerindo uma observância às boas práticas de manipulação em relação ao mel. Oliveira et al. (1984, p. 72) alertam que a presença desses microrganismos indicadores pode sugerir também a possível presença de outros microrganismos de maior patogenicidade e mais difíceis de serem detectados que os do grupo coliforme. Esses resultados podem ser explicados pela composição físico-química do mel, que determina qual microrganismo será capaz ou não de se desenvolver (SILVA, 2000; SEREIA, 2005, p. 112).Alguns trabalhos relacionados à quantificação de microrganismos no mel foram desenvolvidos, porém a maioria analisando o mel produzido por A. mellifera, sendo ainda poucos os trabalhos com mel de abelhas sem ferrão, como a Melipona compressipes.Em amostras de mel de Camarões, produzido por A. mellifera, Tchoumboue et al. (2007) encontraram presença de contaminação por microrganismos em mais de 73,4% das amostras analisadas, atribuindo esta contaminação ao processamento pós-colheita ou adulteração do produto, uma vez que sua amostra de mel testemunha não apresentou estes níveis de contaminação.
CONCLUSÕES: Os métodos de análise aplicados neste estudo constituíram uma ferramenta eficiente e rápida para o diagnóstico de comprovação da qualidade microbiológica das amostras de mel. Os resultados observados apresentaram-se dentro dos parâmetros estabelecidos e aceitos pelos órgãos oficiais e pela comunidade científica, permitindo atestar excelente qualidade para o mel produzido pelas abelhas Melipona compressipes e Apis Mellifera no Estado do Maranhão.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: 1.BRASIL. Ministério da Agricultura e do Abastecimento. Instrução Normativa nº 11, de 20 de outubro de 2000. Regulamento Técnico de Identidade e Qualidade do Mel. Brasília; 2000, p. 29.
2.DUARTE AWF, LINS SEM, NORMANDE ACL, ALVES MAM, OLIVEIRA EG. Avaliação da qualidade microbiológica de méis coletados em casas de mel no município de Pão-de-açúcar, Alagoas. Trabalho apresentado ao 16º Congresso Brasileiro de Apicultura. Aracaju, AL; 2006.
3.HITCHINS AD, HARTMAN PA, TODD ECD. Coliforms – Escherichia coli and its toxins. In: Vanderzant C, Splittstoesser DF, editores. Compendium of methods for the microbiological examinations of foods. 3a. ed. Washington: American Public Health Association (APHA); 1992. p. 325-69.
4.OLIVEIRA, C. P. S.; CABRAL, T. M. A.; LIMA, A. W. O. Coliformes totais e fecais e caracterização dos coliformes fecais em queijo tipo coalho comercializado em João Pessoa - PB. Ciência, cultura, saúde, v. 6, n. 1, p. 34-38, 1984.
5.PEELER JT, HOUGHTBY GA, RAINOSEK AP. The most probable number technique. In: Vanderzant C, Splittstoesser DF, editores. Compendium of methods for the microbiological examinations of foods. 3a. ed. Washington: American Public Health Association (APHA); 1992. p. 105-20. v.33, n.4, p.544-55, out./dez. 2009.
6.SILVA N, JUNQUEIRA VCA, SILVEIRA NFA. Manual de métodos de análises microbiológicas de alimentos. São Paulo: Varela; 1997, p. 99.
7.SILVA, A.C; BRINGEL, J.M.M. Projeto e ações: em Biologia e Química. São Paulo: UEMA, 2006, p 57.
8.SNOWDON JA, CLIVER DO. Microorganisms in honey. Intern. J. Food Microb. 1996; p. 31.
