ÁREA: Química Analítica
TÍTULO: Síntese e caracterização térmica de compostos de Mn com o Ácido tânico
AUTORES: SIQUEIRA, A. B. (CUA/UFMT) ; GUIMARÃES, B. V. (CUA/UFMT) ; CARDOSO, A. P. (CUA/UFMT) ; BRITO, C. C. (CUA/UFMT) ; IONASHIRO, M. (IQ/UNESP) ; CAIRES, F. J. (IQ/UNESP)
RESUMO: O desenvolvimento de técnicas que utilizam meios naturais para minimizar os impactos ambientais causados pelo processo industrial vem crescendo gradativamente. O tanino vegetal é um exemplo que está tendo resultados positivos no tratamento de água e efluentes, substituindo o sulfato de alumínio no processo de floculação, coagulação, clarificação e decantação dos líquidos. Este trabalho teve como objetivo sintetizar, e estudar o comportamento do ácido tânico com o manganês bivalente em pH 3,0, em pH 5,0 e via carbonato. Os compostos sólidos obtidos foram caracterizados utilizando-se as técnicas TG – DTA (termogravimetria - análise térmica diferencial simultânea), DSC (Calorimetria exploratória diferencial), Espectroscopia de absorção na região do infravermelho, Análise elementar.
PALAVRAS CHAVES: tg, ácido tânico, manganês
INTRODUÇÃO: A crescente demanda por água tratada tem feito do reuso planejado de água um tema atual e de grande importância. Reuso é o processo de utilização da água por mais de uma vez, tratada ou não, para o mesmo ou outro fim. A grande vantagem da utilização da água de reuso é a de preservar água potável exclusivamente para atendimento de necessidades que exigem a sua potabilidade, como para o abastecimento humano.[1]
As águas são poluídas, basicamente, por dois tipos de resíduos: os orgânicos, formados por cadeias de carbono ligadas a moléculas de oxigênio, hidrogênio e nitrogênio, e os inorgânicos, que têm composições diferentes. Os resíduos orgânicos normalmente são biodegradáveis, ou seja, são destruídos naturalmente por microorganismos, porém, esse processo de destruição acaba consumindo a maior parte do oxigênio dissolvido na água, o que pode compreender a sobrevivência de organismos aquáticos. Já os resíduos inorgânicos vêm de indústrias - principalmente as químicas e petroquímicas - e não podem ser decompostos naturalmente. Dentre os mais nocivos estão os chamados metais tóxicos - chumbo, mercúrio, cádmio, cromo, manganês e níquel. Se ingeridos, podem causar diversas disfunções pulmonares, cardíacas, renais e do sistema nervoso central, entre outras. [2]
As indústrias e os sistemas de tratamentos de água públicos vêm buscando melhorar e ao mesmo tempo diminuir o custo para limpar(tratar) as águas das substâncias que são maléficas ou que atrapalham no uso das mesmas. Este trabalho tenta viabilizar estas metas a partir do estudo e conhecimento das interações do ácido tânico com os metais.
MATERIAL E MÉTODOS: As solução do metal (0,1 mol L-1) foram preparadas e padronizadas de forma a serem adicionadas estequiometricamente (1:1) nas soluções preparadas de ácido tânico (0,1 mol L-1), após a mistura, quando necessário, era adicionado uma solução de hidróxido de sódio para ajustar a solução em pH = 3 e em pH 5,0.
Na precipitação via carbonato, as soluções dos metais serão transformadas em seus respectivos carbonatos e posterior adição das soluções de ácido tânico.
Os sistemas sólidos foram estudados e caracterizados utilizando-se as técnicas TG-DTA, DSC, espectroscopia de absorção na região do infravermelho e análise elementar.
As curvas TG-DTA foram obtidas no termoanalisador SDT 2960, da TA instruments. A análise das amostras foram realizadas no intervalo de 30 a 1000 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco com fluxo de 100 mL min-1, cadinhos de α-alumina e massa da amostra da ordem de 3,000 mg.
As curvas DSC foram obtidas no analisador DSC Q10 da TA instruments. A análise das amostras foram realizadas no intervalo de 30 a 600 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco com fluxo de 50 mL min-1, cadinhos de alumínio com tampa perfurada e massa da amostra da ordem de 1,000 mg.
Os espectros vibracionais foram obtidos no espectrofotômetro Nicolet (4000 – 600 cm-1), com resolução de 4 cm-1, usando a técnica de reflectância difusa.
Os resultados obtidos pela análise de carbono e de hidrogênio fornecem informações importantes com relação à estequiometria dos compostos sintetizados. A análise foi realizada no micro-analisador CHN, modelo 2400 da Perkin Elmer.
RESULTADOS E DISCUSSÃO: As curvas termogravimétricas e a confirmação da análise elementar de C, H e O permitiram estabelecer a relação estequiométrica dos metais nos diferentes sistemas de misturas. Em pH 3,0 a relação estequiométrica proporcionou um composto sólido com fórmula molecular igual a MnL1,5.11H2O, em pH 5,0 a relação estequiométrica foi de Mn3L.3H2O e a mistura via carbonato resultou na fórmula molecular igual a MnL2.19H2O.
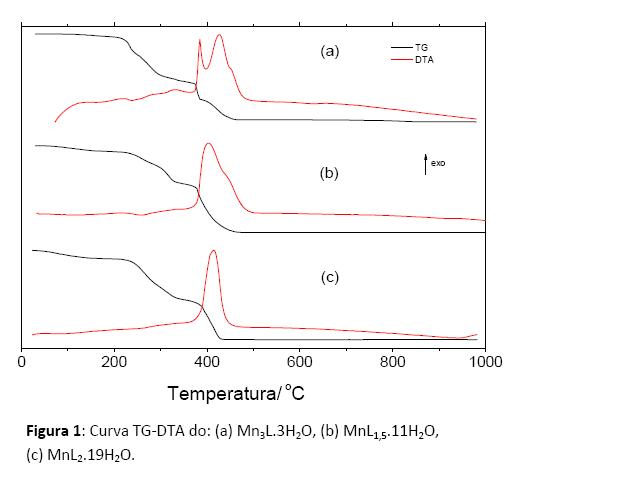
As curvas TG-DTA, ver Figura 1, dos compostos mostram que a decomposição térmica dos compostos ocorrem em 3 (compostos MnL1,5.11H2O e MnL2.19H2O) e 5(Mn3L.3H2O) etapas consecutivas. A desidratação do MnL2.19H2O ocorre em uma única etapa entre 35-182 ºC. A decomposição térmica do composto anidro se inicia em 213 ºC e termina em torno 433 ºC, com um pico exotérmico em 414 ºC. O resíduo Mn3O4 (ΔmCalcd. = 97,99%; ΔmTG = 97,93%) se mantém estável. A decomposição térmica do MnL1,5.11H2O ocorre em 3 etapas consecutivas, sendo a primeira entre 48 e 165 ºC, equivalente a desidratação térmica do composto. A decomposição térmica do composto anidro ocorre entre 165 e 480 ºC, com um pico endotérmico em 258 ºC e um pico exotérmico em 403ºC. A formação do Mn3O4 (ΔmCalcd. = 97,28%; ΔmTG = 97,41%) se mantém estável.
A desidratação térmica do Mn3L.3H2O ocorre entre 84 e 196 ºC. A decomposição térmica do composto anidro ocorre em 3 etapas consecutivas entre 196ºC e 469ºC. Entre 469 ºC e 875 ºC ocorre à queima do resíduo carbonáceo com formação do Mn3O4 (ΔmCalcd. = 88,09%; ΔmTG = 88,19 %).
Nas Curvas DSC são observados picos exotérmicos acima de 300 ºC que são atribuídos à oxidação da matéria orgânica.
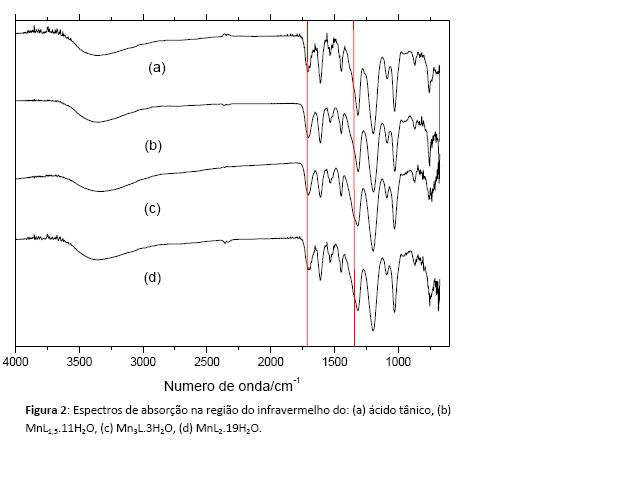
A investigação dos dados espectroscópicos dos compostos sintetizados foi comparado ao espectro do ácido tânico, sendo observado deslocamento em algumas bandas, ver Figura 2.
CONCLUSÕES: Os resultados da termogravimetria, da análise térmica diferencial e da análise elementar forneceram informações sobre a composição estequiométrica, desidratação, estabilidade e decomposição térmica dos compostos sólidos sintetizados.
As análises dos espectros de absorção na região do infravermelho do ácido tânico e dos compostos sintetizados mostram um deslocamento nas bandas dos espectros dos compostos obtidos em pH 5 e via carbonato, mostrando que neste compostos ocorre uma interação maior do metal com o ligante do que no compostos preparado em pH 3.[3]
AGRADECIMENTOS: CNPQ, CAPES, FAPESP, CUA/UFMT
REFERÊNCIAS BIBLIOGRÁFICA: 1. Üçer, A.; Uyanik, A.; Aygün. Ş. F. Adsorption of Cu(II), Cd(II), Zn(II), Mn(II) and Fe(III) ions by tannic acid immobilised activated carbon. Separation and Purification Technology, v. 47, pp. 113–118, 2006.
2. MACHADO, C. J. S.; Reuso da água doce. Revista Eco•21, edição 86, janeiro 2004, Disponível em: http://www.eco21.com.br. Último acesso em 01/04/2008.
3. NAKAMOTO, K. Infrared and raman spectra of inorganic and coordination compounds. Part B. 5th ed. New York: John Wiley & Sons, 1997. p. 57-62.
