ÁREA: Química Analítica
TÍTULO: CINÉTICA DE DECOMPOSIÇÃO TÉRMICA DE QUELATOS METÁLICOS DA 5-NITRO-8-QUINOLINOL
AUTORES: APPELT, PATRÍCIA. (UTFPR)
RESUMO: Diversos estudos para determinação de parâmetros cinéticos estão reportados na literatura, empregando métodos isotérmicos e não isotérmicos. Neste trabalho são apresentados os resultados obtidos para a determinação de parâmetros cinéticos de decomposição térmica utilizando o método de Kissinger, de 5-nitro-8-quinolinatos de chumbo, titânio e zircônio. Através da análise térmica diferencial foi possível determinar a energia de ativação de cada etapa de decomposição térmica dos quelatos, bem como o local em que ocorre a primeira quebra da molécula. Esta quebra foi confirmada pelas etapas de perda de massa acompanhadas pelas curvas termogravimétricas.
PALAVRAS CHAVES: quelatos metálicos, cinética de decomposição, 5-nitro-8-quinolinol
INTRODUÇÃO: A determinação de parâmetros cinéticos por decomposição térmica pode ser realizada por métodos isotérmicos e não isotérmicos. O método de Kissinger (ZOREL, 2001) permite o cálculo da energia de ativação, Ea, pela análise dos picos das curvas de análise térmica diferencial, a partir da equação da/dT = (A/b) f(a)Tnexp(-Ea/RT), sendo a a fração de decomposição, T a temperatura (K), A o fator pré-exponencial (1/s), b a taxa de aquecimento (K min-1), Ea a energia de ativação (J mol-1) e R a constante universal dos gases (8,314 J K-1 mol-1). Sendo A uma constante independente da taxa de aquecimento e (d2a/dT2) igual a 0 na temperatura de pico na curva DTA, obtém-se a equação cinética geral do método de Kissinger: ln(b/Tp2)= - (Ea/RT) + ln [(f’(ap))AR/Ea], sendo Tp a temperatura do pico na curva DTA. Fazendo um gráfico de ln(b/Tp2) contra 1/Tp obtém-se uma reta cujo coeficiente angular é – Ea/R. O método não isotérmico é rápido uma vez que as análises são realizadas sob aquecimento contínuo, atingindo-se facilmente as transformações estudadas, quer sejam efeitos físicos ou químicos. Neste trabalho são apresentados os estudos de determinação da energia de ativação das etapas de decomposição térmica de quelatos metálicos obtidos a partir da 5-nitro-8-quinolinol.
MATERIAL E MÉTODOS: A obtenção dos quelatos metálicos foi realizada pela dissolução do quelante em meio acetona, adição lenta de solução aquosa dos nitratos metálicos e elevação do pH, pela adição de solução aquosa de amônia, até precipitação total dos quelatos. Estes foram filtrados, lavados com água destilada, secos a 60°C por 24horas em estufa de circulação forçada e armazenados em dessecador (ZOREL et al, 2003).
Os quelatos foram analisados por Análise Elementar para determinação de C, H e N, utilizando analisador elementar da CE Instruments, modelo EA 1110-CHNS-O, para determinação da composição. O estudo do comportamento térmico foi realizado por Termogravimetria e Análise Térmica Diferencial, utilizando módulo de análise térmica simultâneo, SDT 2960 da TA Instruments, sob diferentes taxas de aquecimento e atmosfera dinâmica de ar sintético.
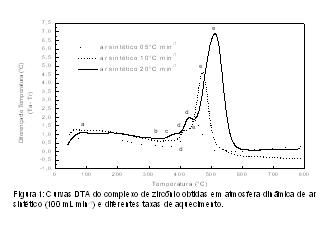
RESULTADOS E DISCUSSÃO: Os resultados obtidos por análise elementar indicam que os quelatos metálicos foram obtidos na proporção de 1:2 de metal/ligante, apresentando as seguintes estequiometrias: Pb(C9H5N2O3)2, TiO(C9H5N2O3)2.0,5H2O e ZrO(C9H5N2O3)2.2H2O. As curvas termogravimétricas indicam que os compostos apresentam comportamento térmico semelhantes, com a primeira etapa de decomposição térmica sendo atribuída à desidratação dos quelatos e as demais à decomposição/oxidação dos compostos anidros. O estudo cinético de decomposição térmica dos quelatos foi realizado sob atmosfera dinâmica de ar sintético e diferentes taxas de aquecimento. A figura 1 contém as curvas DTA do quelato de zircônio, representativo para os demais quelatos.
Observa-se que, com o aumento da taxa de aquecimento, as temperaturas dos picos de desidratação e decomposição térmica aumentam de forma proporcional, indicando que o mecanismo de decomposição térmica não é alterado.
Utilizando a temperatura do pico indicado pela letra e como representativo, podemos construir o gráfico de ln(b/Tp2) contra 1/Tp obtendo-se uma reta, como indicado na figura 2. Através do coeficiente angular obtido pela equação da reta, e utilizando a equação b = – Ea/R, pode-se determinar a Energia de Ativação de cada etapa da decomposição dos quelatos. Para os quelatos estudados, a primeira etapa de decomposição térmica dos compostos anidros, apresenta uma energia de ativação próxima a 280 kJ mol-1 e é atribuída à quebra da molécula na posição do grupo nitro. As demais etapas de decomposição apresentaram energias de ativação bastante inferiores.

CONCLUSÕES: A determinação de parâmetros cinéticos é importante para o esclarecimento do mecanismo de decomposição térmica. O método não isotérmico utilizado mostrou-se eficiente e de fácil aplicação, permitindo concluir que o mecanismo de decomposição térmica dos quelatos anidros estudados é igual, iniciando pela liberação dos grupos nitros.
AGRADECIMENTOS: Os autores agradecem a FAPESP pelo apoio.
REFERÊNCIAS BIBLIOGRÁFICA: ZOREL Jr., H. E.; COSTALONGA, A. G. C.; CRESPI, M. S.; RIBEIRO, C. A. 2001. Comportamento térmico do 8-quinolinol e seus nitro-derivados. Química Nova, 24 (5), 599-603.
ZOREL Jr., H. E.; CRESPI, M. S.; RIBEIRO, C. A. 2003. Thermal Behavior and Decomposition Kinetics of theof the Ti (IV), Zr (IV) and Pb (II) Complexes with 5-nitro-8-hydroxyquinoline in the Solid State. Journal of Thermal Analysis and Calorimetry, 72, 507-514.
