ÁREA: Química Analítica
TÍTULO: SÍNTESE E CARACTERIZAÇÃO DO MALONATO DE La (III) NO ESTADO SÓLIDO
AUTORES: LOCATELLI, J. R. (AFA) ; CARVALHO, C. T. (UNESP) ; CAIRES, J. F. (UNESP) ; LIMA, L. S. (UNESP) ; DAMETTO, P. R. (UNESP) ; AMBROZINI, B. (UNESP) ; NUNES, R. S. (UNESP) ; IONASHIRO, M. (UNESP)
RESUMO: Foi sintetizado o composto La2M3.nH2O onde M = malonato, no estado sólido. O composto sintetizado foi analisado por termogravimetria-análise térmica diferencial simultâneo (TG-DTA), calorimetria exploratória diferencial (DSC), espectroscopia de absorção na região do infravermelho. Os resultados das análises termoanalíticas permitiram sugerir a relação estequiométrica metal/ligante/água.
PALAVRAS CHAVES: malonato, lantânio,comportamento térmico
INTRODUÇÃO: Recentemente, muitos trabalhos foram realizados com malonatos de lantanídeos (MURAISHI et al., 1991), para verificação de propriedades térmicas e magnéticas (NISHIMINE et al., 2005), estabilidade termodinâmica (MATSKEVICH et al., 2004). Também, foram sintetizados o-metoxibenzoato com o subgrupo do cério (MARUSHOVA et al., 1984) e o 4-metoxibenzoato do lantânio e lantanídeos, com exceção do promécio (RODRIGUES et al., 2005). Nesse composto foram estudadas algumas propriedades como estabilidade térmica e comportamento térmico.
No presente trabalho foi sintetizado o malonato de lantânio e estudado, utilizando-se as técnicas termoanalíticas como termogravimetria e análise térmica diferencial simultânea (TG-DTA), calorimetria exploratória diferencial (DSC) e espectroscopia de absorção na região do infravermelho.
MATERIAL E MÉTODOS: O malonato de lantânio (III) foi preparado no estado sólido, pela adição estequiométrica, lenta e sob agitação, de soluções de malonato de sódio (ligante) na solução de cloreto metálico, preparado anteriormente. O precipitado obtido foi filtrado com papel de filtro Whatman no 42, lavados com água destilada até a eliminação dos íons cloretos, recolhido em frasco de vidro e mantido em dessecador contendo cloreto de cálcio.
As curvas TG-DTA foram obtidas no termoanalisador SDT 2960, da TA Instruments. A análise das amostras foram realizadas no intervalo de 30 – 1000 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco, com fluxo de 100 mL min-1, cadinhos de alfa-alumina e massa da amostra da ordem de 7 mg.
A curva foi obtida no anlisador DSC Q10 da TA Instruments, com intervalo de 30 – 600 ºC, razão de aquecimento de 20 ºC min-1, atmosfera de ar seco com fluxo de 50 mL-1, cadinhos de alumínio com tampa perfurada e massa da amostra da ordem de 5 mg.
O espectro de absorção na região do infravermelho foi obtido com emprego do espectrofotrômetro Nicolet iS10 FT-IR , usando um acessório ATR com janela de Ge, com resolução de 4cm-1, na região de 4000 – 600 cm-1.
RESULTADOS E DISCUSSÃO: Nas curvas TG-DTA (Fig. 1) as duas primeiras etapas com perda de 12,4% (TG) e picos endotérmicos em 100 ºC e 150 ºC (DTA) referente a 4,5 H2O de hidratação. As terceira e quarta etapas com perdas de massa de 13,4% e 7,0% (TG), respectivamente, são atribuídas a oxidação da matéria orgância, entretanto, na curva DTA somente é observado um único pico (referente a quarta etapa) em 400 ºC. Entretanto, não aparece o pico referente a terceira etapa porque ocorrem eventos endo e exo sem saldo de calor na curva DTA. Após a quarta etapa, sugere-se a formação de uma mistura de carbornato e oxicarbonato e material carbonizado. Um largo pico exotérmico em 660 ºC é atribuído a oxidação do material carbonizado. A quinta etapa com perda de massa de 3,7% (TG) é atribuída a decomposição do carbonato e oxicarbonato com formação de La2O3.
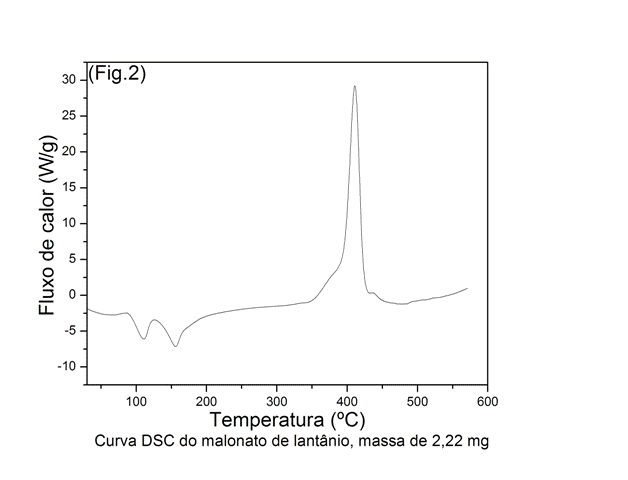
Na DSC (Fig. 2), observa-se dois picos endotérmicos referentes a água de hidratação, um a 110 oC e outro a 156 oC, com entalpias iguais a 67 e 73 J/g, respectivamente, e pico exotérmico referente a decomposição da matéria orgânica a 410,9oC.
FTIR - O íon carboxilato (DEACON et. al., 1980) coordena-se ao metal dos seguintes modos: unidentados, quelantes-bidentados e complexos em ponte, sendo possível sugerir que a diferença entre as freqüências de estiramento assimétrico e simétrico do ânion carboxilato dos compostos sintetizados em relação ao sal de sódio , ∆ [νas (COO-) - νsim (COO-)] , para estruturas unidentadas o valor de ∆ é muito maior que o observado para o sal, estruturas quelantes-bidentadas o valor de ∆ é inferior ao sal, estruturas em ponte o valor de ∆ é muito próximo ao valor de ∆ do malonato de sódio. De acordo com os valores de ∆ encontrados sugere-se que o lantânio coordena-se ao ligante (malonato) de forma bidentada.
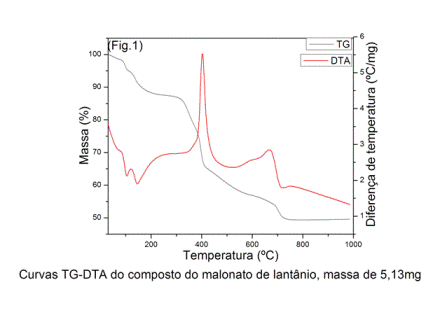
CONCLUSÕES: Os resultados das curvas TG-DTA forneceram informações sobre a composição (La2M3.4,5H2O) onde M = malonato, desidratação, estabilidade e decomposição térmica do malonato de lantânio.
A curva DSC mostrou que a entalpia de desidtração para o malonato de lantânio é 67 J/g .
A análise dos espectros de absorção na região do infravermelho possibilotou sugerir que o ligante coordena-se ao metal de forma bidentada.
AGRADECIMENTOS: Academia da Força Aérea (AFA), Instituto de Quimica - Araraquara (UNESP)
REFERÊNCIAS BIBLIOGRÁFICA: 1.DEACON, G. B.; PHILLIPS, R. J. 1980. Relationships between the carbon-oxygen stretching frequencies of carboxylato complexes and the type of carboxylate coordination. Coord. Chem. Rev., 33: 227 – 250.
2.MAKUSHOVA, G. N.; PIRKES, S. B. 1987. Infrared spectroscopy and thermalgravimetry investigation of lanthanides m-methoxybenzoates. Russ. J. Inorg. Chem., 32: 489 – 491.
3. MATSKEVICH, N. I.; WOLF, T. 2004. Formation enthalpies and thermodynamic stability of the Sm1+xBa2-xCu3Oy solid solutions. Thermochim. Acta, 421: 231 – 233.
4. MURAISHI, K.; YOKOBAYASHI, H.; NAGASE, K. 1991. Systematics on the thermal reactions of lanthanide malonatos Ln2(C3H2O4)3.nH2O in solid state. Thermochim. Acta, 182: 209 -217.
5. NISHIMINE, H.; WAKESHIMA, M.; HINATSU, Y. 2005. Structures, magnetic, and thermal properties of Ln3MoO7(Ln = La, Pr, Nd, Sm, and Eu). J. Solid State Chem., 178: 1221 – 1229.
6. RODRIGUES, E. C.; IONASHIRO, E. Y.; VALLEJO, A. C.; BANNACH, G.; IONASHIRO, M. 2005.Synthesis, characterization and thermal studies on solid 3-methoxybenzoate of some bivalent transition metal íons. Ecl. Quim., 30: 7 – 13.
