ÁREA: Bioquímica e Biotecnologia
TÍTULO: OBTENÇÃO DE HESPERIDINA APARTIR DE POLPA CÍTRICA PELETIZADA.
AUTORES: BATISTA, W. P. (RENORBIO) ; VIEIRA, I. G. P. (PADETEC) ; MENDES, F. N. P. (PADETEC) ; CRAVEIRO, A. A. (PADETEC) ; LIMA SILVA, A. N. (UECE)
RESUMO: As técnicas descritas na literatura para obtenção de bioflavonóides cítricos são métodos para produção de glicosídeos de flavanonas, a partir principalmente da casca da laranja, sendo a hesperidina o seu principal constituinte. Embora empregados industrialmente, estes métodos apresentam um baixo rendimento (0,43%) e o produto obtido possui um baixo teor de hesperidina (35% por CLAE). Foi desenvolvido um novo processo na qual a matéria prima utilizada é a Polpa Cítrica Peletizada – PCP um subproduto da industria de sucos. Neste processo as impurezas presentes na PCP são removidas e o resíduo obtido é submetido à extração para separação dos citroflavonóides, que após purificação por recristalização produzem hesperidina, com teor maior que 95% e rendimento maior (próximo de 2% da PCP).
PALAVRAS CHAVES: hesperidina, polpa cítrica, método de extração;
INTRODUÇÃO: Compostos bioativos como os Bioflavonóides cítricos podem ser extraídos de materiais vegetais, com a utilização de solventes, em operações clássicas aplicadas e em muitos processos industriais, na industria farmacêutica (MA Y. et al., 2008). Alguns medicamentos são compostos de hesperidina metilchalcona, ácido ascórbico e um extrato de flores (Ruscus aculeatus) por possuírem um efeito agonista alfa-adrenérgico, que é um efeito protetor dos capilares arteriovenosos (ARRIOLA et al., 2005). Os flavonóides possuem propriedades como antifúngicas, antibacterianas, antioxidantes, que aumentam a sobrevivência das plantas (PRESTA, 2008). Podem afetar a saúde humana e animal por estarem presentes na dieta diária apresentando ação antioxidante (RICE-EVANS et al., 1997) ou ação hormonal (MIKSICEK, 1993) e ampla variedade de atividades anti-microbiana e farmacológica.
A Polpa Cítrica Peletizada (PCP) é um subproduto da industria de sucos, fazendo parte dos alimentos ditos “concentrados fibrosos” que vem sendo estudados como substitutos de alimentos concentrados ou onde as forragens são escassas ou de baixa qualidade nas dietas de animais como aves, bovinos, equinos e suínos (SILVA & MACHADO, 1998).
O objetivo principal deste trabalho foi o desenvolvimento de um método prático no aproveitamento dos resíduos produzidos pela indústria de sucos, como a Polpa Cítrica Peletizada (PCP), além de aumentar o valor agregado dos produtos. Após a extração da hesperidina, o resíduo obtido poderá ser recomposto, que após secagem poderá ser utilizado como ração animal. As metodologias aplicadas tiveram como foco principal a diminuição dos custos operacionais, o aumento do rendimento, a obtenção da hesperidina com maior grau de pureza e principalmente um aproveitamento para a PCP.
MATERIAL E MÉTODOS: A matéria prima utilizada foi Polpa Cítrica Peletizada adquirida no comércio local (Fortaleza-CE) sem marca aparente e utilizada como ração animal.
Extração: Foram realizadas duas lavagens com água na proporção 6:1 (água:PCP) para que os açúcares e as impurezas fossem retiradas. Em seguida foram realizadas 9 (nove) extrações com metanol aquecido na proporção de 6:1 (metanol:PCP). O extrato metanólico foi concentrado, filtrado e seco.
Purificação da Hesperidina: O material seco obtido da extração foi purificado por dissolução em solução de hidróxido de sódio 10%, seguido de tratamento com carvão ativado e filtração. O produto da filtração foi acidificado com ácido clorídrico diluído (pH 4,5), filtrado, lavado com água e seco em estufa.
Caracterização:
Determinação de Umidade: Segundo Normas do Instituto Adolfo Lutz (1985).
Determinação de Cinzas: De acordo com o processo gravimétrico, segundo o método n. 930.05 da AOAC (1995).
Determinação dos Açúcares: A composição monossacarídica dos açúcares foi obtida das águas de lavagem da PCP e submetidas a cromatografia de camada delgada. Os açúcares foram analisados em função da verificação da presença de sacarose, frutose e galactose.
Caracterização por Cromatografia de Camada Delgada (CCD) e Líquida de Alta Eficiência (CLAE): Os citroflavonóides foram analisados por CCD em sílica gel utilizando como eluente a mistura acetato de etila:ácido fórmico:metiletilcetona:água (50:10:30:10) em comparação com o padrão de hesperidina. Para a cromatografia líquida soluções de 100µg/mL do padrão e das amostras de hesperidina bruta e purificada foram preparadas. Em seguida estas soluções foram filtradas em membrana com poro de 0,45µm, injetadas no cromatógrafo líquido (SHIMADZU) e processada em 330nm (XU L. et al., 2009).
RESULTADOS E DISCUSSÃO: O processo de extração realizado com auxilio do metanol, após concentração e secagem, apresentou 2,4% de rendimento para a hesperidina bruta que após purificação produziu 1,73% de rendimento de um produto cristalino com ponto de fusão 260-261ºC. O produto obtido atende as especificações exigidas para a hesperidina grau farmacêutico. Conforme dados abaixo:
TESTE REALIZADOS ESPECIFICAÇÕES
Perda por dessecação: ........................ 5,0% (Max);
Cinzas: ............................................... 0,2%;
Doseamento (HPLC): ........................ 95% (min);
A determinação de açúcares foi realizada por CCD comparando os Rf´s característicos dos padrões, sendo possível verificar a presença de galactose, frutose e sacarose. Enquanto que a hesperidina obtida bruta e purificada foi analisada em CCD produzindo um Rf 0,59, idêntico ao descrito pela literatura para a hesperidina (WINGARD, 1979) e idêntico a hesperidina padrão feitas na mesma placa. Na CLAE a injeção da amostra padrão gerou um gráfico padrão para a hesperidina mostrado na figura 1. A injeção da hesperidina produzida foi realizada logo em seguida e o comparativo com o padrão pode ser analizado com os tempos de retenção e o espectro de Ultra – Violeta idênticos e como podemos ver na figura 2.
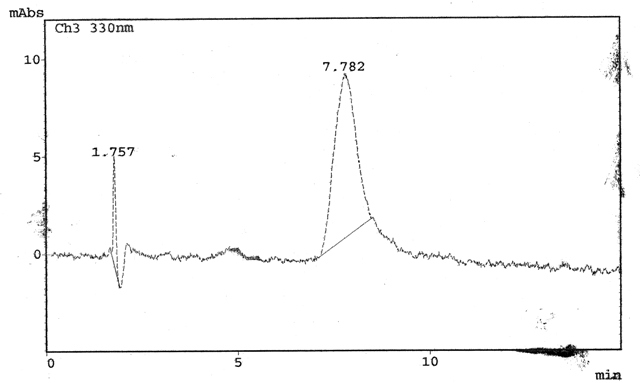
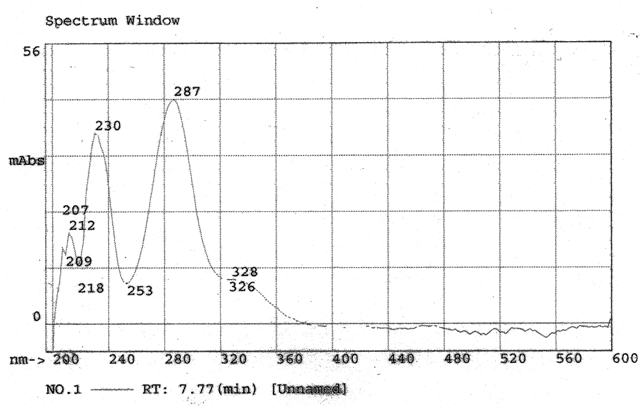
CONCLUSÕES: O método descrito mostrou ser um método bastante eficaz na obtenção da Hesperidina.
Após a realização dos métodos de obtenção da hesperidina podemos verificar que o método de extração com a utilização do metanol apresentou um rendimento superior aos demais métodos descritos na literatura (HIGBY, 1944 e 1947; BATER, 1948) sendo este rendimento cerca de cinco vezes maior que os demais.
Esse método além de ter apresentado um rendimento superior mostrou ser um método mais rápido que os demais métodos.
O método de extração também apresentou elevadas taxas de pureza.
AGRADECIMENTOS: Agradecemos ao PADETEC e ao Cnpq pelo apoio prestado ao grupo e a pesquisa.
REFERÊNCIAS BIBLIOGRÁFICA: AOAC – Association of Official Analytical Chemists. Official Methods of Analysis. 16 ª ed., Arlington, 1995.
ARRIOLA, J. G.; MUÑOZ, C. C.; MARTÍNEZ, A. L.; VALERO, M. R.; FURUSHO, K. Y.; Eficacia del extracto de Fabroven en la enfermedad hemorroidal aguda. Rev Mex Angiol; 33(2): 62-66; 2005.
BATER,W.E.; USPatent 2,422,110; 1948.
HIGBY, H.R.; USP 2,348,215; 1944.
HIGBY, H.R.; USP 2,421,661; 1947.
IAL - Instituto Adolfo Lutz. Normas Analíticas do Instituto Adolfo Lutz. 3 ed. São Paulo, v.1, 533p, 1985.
MA, Y.; YE, X.; HAO, Y.; XU, G.; XU, G.; LIU, D.; Ultrasound-assisted extraction of hesperidin from Penggan (Citrus reticulata) peel; Ultrasonics Sonochemistry 15 (2008) 227–232;
MIKSICEK, R. J. Commonly occurring plant flavonoids have estrogenic activity. Mol. Pharmacol. 44, 37-43; 1993.
PRESTA, M. A.; Determinação de Flavonódes e Resveratrol em Vinho Empregando Cromatografia de Fluxo Turbulento – LC – MS.; Tese de Doutorado; Santa Catarina – RS, Brasil, 2008.
RICE-EVANS, C. A.; MILLER, N. J.; PAGANGA, G.; Antioxidant properties of phenolic compounds. Trends in Plant Science, v. 2, n. 4, p. 152-159, 1997.
SILVA, L. F. P.; MACHADO, P. F.; O uso da Polpa Cítrica Peletizada na Alimentação de Ruminantes. Piracicaba: USP, 1998.
XU, L.; HAN, X.; QI, Y.; XU, Y.; YIN, L.; PENG, J.; LIU, K.; SUN, C.; Multiple compounds determination and fingerprint analysis of Lidanpaishi tablet and keli by high-performance liquid chromatography; Analytica Chimica, Acta 633, 136-148, 2009.
WINGARD, R. E.; US Patent , 4,150,038; 1979 .
