ÁREA: Bioquímica e Biotecnologia
TÍTULO: Estudos espectroscópicos da interação dos surfactantes iônicos dodecil sulfato de sódio (SDS) e cloreto de cetiltrimetilamônio (CTAC) com a cadeia monomérica d da hemoglobina extracelular gigante de Glossoscolex paulistus.
AUTORES: RIBELATTO, J.C. (IQSC-USP) ; POLI, A.L. (IQSC-USP) ; MOREIRA, L.M. (IQSC-USP) ; IMASATO, H. (IQSC-USP)
RESUMO: Neste trabalho é apresentado o estudo da interação do monômero d da hemoglobina de Glossoscolex paulistus (HbGp) na forma oxi em pH 7,0 com os surfactantes iônicos: dodecil sulfato de sódio (SDS) e o cloreto de cetiltrimetilamônio (CTAC). Os espectros de UV-Vis para o sistema HbGp-SDS evidenciam a oxidação do centro ferroso, através da formação do hemicromo. Para o sistema HbGp-CTAC, observa-se o surgimento de uma banda de transferência de carga do ligante para o metal (TCLM) em 605 nm caracterizando a formação da espécie pentacoordenada. Medidas de espectroscopia de fluorescência do SDS e CTAC evidenciam um aumento do rendimento quântico nas concentrações iniciais de detergente. Em concentrações mais elevadas, ocorre a desnaturação da subunidade monomérica d.
PALAVRAS CHAVES: técnicas espectroscópicas, hemoglobina extracelular, surfactantes iônicos
INTRODUÇÃO: A hemoglobina extracelular gigante de Glossoscolex paulistus (HbGp) é uma proteína oligomérica, que apresenta uma massa molecular mínima de 3,1 MDa, com 144 globinas e 36 cadeias polipeptídicas sem o grupo prostético heme (cadeias Linkers), que são cruciais para sua integridade estrutural. O arranjo quaternário da hemoglobina íntegra se dispõe espacialmente como 2 discos hexagonais sobrepostos, com as subunidades estabilizadoras Linkers na porção central desse arranjo oligomérico, que é conhecido usualmente como “modelo do bracelete” (ROYER et al., 2001)(VINOGRADOV, 2004). As 144 globinas estão organizadas como 12 dodecâmeros, sendo que cada dodecâmero consiste em um conjunto de três tetrâmeros. Cada tetrâmero, por sua vez, é constituído por três trímeros (cadeias monoméricas a, b, c unidas covalentemente através de ligações dissulfeto) e uma cadeia monomérica d. Este último constituinte, o monômero d, é mantido na estrutura oligomérica por interações de van der Waals, iônicas e ligações de hidrogênio, sendo, portanto, muito sensível às condições de pH e concentração da solução da HbGp. O uso de detergentes em pesquisas nas áreas de biofísica e bioquímica tem se tornado uma prática muito freqüente em função da versatilidade dos surfactantes como sistemas modelo de membrana biológica entre outras aplicações. De fato, o uso de dodecil sulfato de sódio (SDS) em eletroforese em gel de poliacrilamida (SDS-PAGE) para se determinar a composição polipeptídica e estimar a massa molecular de proteínas. A interação entre surfactantes e proteínas globulares tem sido estudada através de uma variedade de técnicas espectroscópicas visando à obtenção de informações relevantes com respeito à relação estrutura-atividade da protéinas (JONES et al., 1995).
MATERIAL E MÉTODOS: O monômero d utilizado foi obtido a partir da oxi-hemoglobina íntegra empregando-se uma coluna de gel Sephadex G-200 em tampão TRIS-HCl 20 mmol L-1, pH 9,0 com 0,1 mM EDTA (IMASATO et al., 1995). Os espectros de absorção eletrônica na região do ultravioleta-visível foram obtidos utilizando um espectrofotômetro Shimadzu modelo UV-1601 PC à temperatura ambiente. Para as medidas de emissão de fluorescência foi utilizado um espectrofluorímetro HITACHI F-4500. O comprimento de onda de excitação foi de 295 nm e o espectro de emissão acompanhado entre 305 a 450 nm. Os espectros obtidos foram armazenados com o objetivo de serem posteriormente analisados empregando-se o programa CCA (“convex constraint analysis”) de Fasman e colaboradores (PERCZEL et al., 1992). O programa CCA permite calcular os espectros das espécies químicas que coexistem em solução (espectros que foram denominados de espectro base) a partir de um conjunto de espectros experimentais (funções iniciais).
RESULTADOS E DISCUSSÃO: Para concentrações limites de SDS, os espectros de absorção óticos, evidenciam a ocorrência de oxidação do grupo heme do monômero d com SDS. Em maiores concentrações de SDS, ocorrem transformações que sugerem um processo de desnaturação protéica, que foi responsável, pelo aumento de intensidade de fluorescência. Partindo-se da espécie oxi, caracterizada pelas bandas a e b em 541 e 575, respectivamente, obtém-se um espectro característico de uma espécie férrica bis-histidina (hemicromo) com máximos de absorção em 565 para a banda a e 535 para a banda b (AGUSTINHO et al., 1997) (Figura 1). O aumento da intensidade de fluorescência observada nas adições iniciais de surfactante é decorrente da interação do SDS com a cadeia peptídica, causada pelo aumento da distância relativa entre triptofanos e heme assim como pelas mudanças induzidas nas orientações relativas dos triptofanos (TRP) em relação aos grupos supressores, o grupo heme. (CABRAL et al., 2002). Observando os espectros de absorção ótica do oxi-monômero d de G. paulistus em função do CTAC, a banda de Soret está centrada em 415 nm, e as bandas a e b possuem máximos, respectivamente, em 575 nm e 541 nm. Com a adição do CTAC, ocorre a diminuição da intensidade da banda de Soret com o deslocamento do máximo para o azul, 401 nm, juntamente com o surgimento de uma banda de transferência de carga do ligante para o metal (TCLM) em 605 nm que indica a formação de uma espécie férrica pentacoordenada (MOREIRA et al., 2006) (Figura 2). Nos espectros de fluorescência foi observado um aumento do rendimento quântico de emissão. De fato, para concentrações de CTAC até 0,079 mM ocorreu um aumento acentuado do rendimento quântico, devido à diminuição da supressão de fluorescência dos resíduos de TRP.
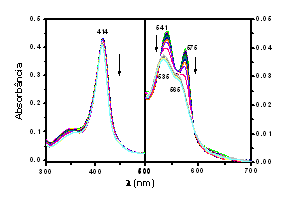

CONCLUSÕES: Através dos estudos de absorção ótica para o SDS e para o CTAC conclui-se que para o SDS ocorre oxidação com uma única transição oxi-hemicromo, sem a formação de uma espécie pentacoordenada. Para o sistema HbGp-CTAC, a oxidação oxi-hemicromo é seguida por uma transição hemicromo-pentacoordenado. Os dados de fluorescência permitem inferir que estas transições na primeira esfera de coordenação do ferro estão associadas a um processo significativo de desenovelamento protéico.
AGRADECIMENTOS:
REFERÊNCIAS BIBLIOGRÁFICA: 1. AGUSTINHO, S. C. M.; TINTO, M. H.; PERUSSI, J. R.; TABAK, M.; IMASATO, H. Comp. Biochem.Physiol, v. 118 A, p. 171-181, 1997.
2. CABRAL, C. B.; IMASATO, H.; ROSA, J. C.; LAURE, H. J.; DA SILVA, C. H. T. P.; TABAK, M.; GARRAT, R. C., GREENE, L.J. Biophysical Chemistry, v. 97, p. 139-157, 2002.
3. IMASATO, H.; TINTO, M. H.; PERUSSI, J. R.; TABAK, M. Comp.Biochem.Physiol., v. 112B, p. 217-226, 1995.
4. JONES, M.N.; CHAPMAN, D. Micelles, monolayers and biomembranes. New
York, John Wiley & Sons, 1995.
5. MOREIRA, L. M.; POLI, A. L.; COSTA-FILHO, A. J.; IMASATO, H. Biophysical Chemistry, v. 124, p.62-72, 2006.
6. PERCZEL, A.; PARK, K.; FASMAN, G.D. Analytical Biochemistry, v.203, p.83-93, 1992.
7. ROYER JUNIOR, W. E.; KNAPP, J. E.; STRAND, K.; HEASLET, H. A. Trends in Biochemical Sciences, v.26, n.5, p.297-304, 2001.
8. SANTIAGO, P. S.; MOREIRA, L. M.; ALMEIDA, E. V.; TABAK, M. Biochimica et Biophysica Acta, v. 1770, n.4, p.506-517, 2007.
9. VINOGRADOV, S N. Micron, v. 35, p. 127-129, 2004.
