ÁREA: IC-Iniciação Científica
TÍTULO: PREPARAÇÃO DE CHALCONAS SUBSTITUIDAS. INTERMEDIÁRIOS SINTÉTICOS PARA O ESTUDO DE REAÇÃO DE RETRO-ALDOL DE A, B-EPOXICETONAS AROMÁTICAS
AUTORES: L. B. PEREIRA*; R. B. DOS SANTOS.
DEPARTAMENTO DE QUíMICA, UNIVERSIDADE FEDERAL DO ESPíRITO SANTO - UFES, AV. FERNANDO FERRARI 514, CEP: 29075-910, VITóRIA, ES.
LEANDRABP@YAHOO.COM.BR
RESUMO: Neste trabalho foram estudadas reações de condensação de Claisen-Schmidt em meio alcalino para a formação de chalconas com diferentes substituintes. As chalconas, a,b-enonas aromáticas (2) foram preparadas utilizando-se como aldeídos aromáticos: benzaldeído, 4-nitrobenzaldeído, 2-metoxibenzaldeído, 4-metoxibenzaldeído, 2,4-dimetoxibenzaldeído, 5-bromo-2-metoxibenzaldeído e como cetonas aromáticas: acetofenona e 4-nitroacetofenona. Os rendimentos dessas reações variaram de 40 a 85%. Os produtos das reações foram analisados por infravermervelho e caracterizados por ponto de fusão.
PALAVRAS CHAVES: chalconas,condensação, dióxido de tiouréia
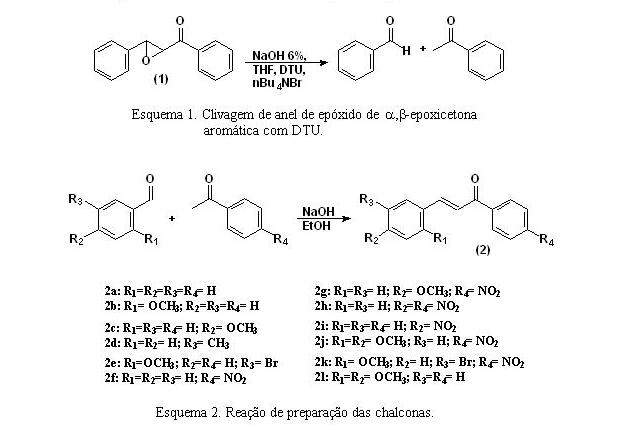
INTRODUÇÃO: O ácido aminoiminometanossulfônico [dióxido de tiouréia (DTU)] foi bastante empregado em química inorgânica como forte redutor para íons de metais. Entretanto, a aplicação de DTU em reações sintéticas, na química orgânica é pouco explorado.Em trabalho anterior (dos SANTOS, 1997), demonstramos que DTU é um reagente eficiente na conversão de α,β-epoxi-cetonas cíclicas em enonas, via uma reação de desoxigenação.Recentemente, mostramos que o DTU pode ser empregado na clivagem de anéis de epóxidos de α,β-epoxicetonas aromáticas em meio alcalino e condições de transferência de fase (CTF), levando a formação de produtos proveniente de uma reação de retro-aldol (dos SANTOS, 2005), representado pela conversão do óxido da benzalacetofenoa (1) em benzaldeido e acetofenona, Esquema 1.Prosseguindo esse estudo, o objetivo desse trabalho foi preparar uma série de chalconas substituídas, via condensação de Claisen-Schmidt para que, posteriormente, sejam convertidas nas respectivas epóxi-enonas e assim, estudar a influência do efeito dos grupos substituintes na reação de clivagem dos anéis dos epóxidos (retro-aldol) com o DTU.
MATERIAL E MÉTODOS: Todas as reações foram realizadas sob agitação magnética a temperatura ambiente ou sob aquecimento. Os solventes utilizados eram de grau técnico e foram purificados por destilação antes do uso. As reações foram acompanhadas por cromatografia em camada delgada utilizando sílica gel como fase estacionária. Os produtos das reações foram caracterizados por infravermelho e por ponto de fusão.
Procedimento padrão de preparação das chalconas: A um balão de fundo redondo, equipado com agitação magnética, contendo 20mL de etanol, adicionou-se 10mmol do aldeído aromático, 10mmol da acetona aromática e 1 mL de NaOH 10%. A mistura resultante foi agitada ou refluxada por cerca de 1 hora. Após esse tempo a mistura foi resfriada para ocorrer a precipitação do produto. Os cristais foram filtrados e lavados com etanol gelado e deixados secar ao ar livre para serem pesados e caracterizados por ponto de fusão e infravermelho.
RESULTADOS E DISCUSSÃO: Neste trabalho relatamos nossos resultados na preparação de uma série de chalconas substituídas visando a síntese de α,β-epoxicetonas aromáticas que serão utilizadas no estudo da clivagem de anéis de epóxido de compostos α,β-epoxi-carbonílicos empregando-se DTU em meio alcalino e sob condições de transferência de fase (CTF).
As chalconas, a,b-enonas aromáticas (2) foram preparadas pela reação de condensação de Claisen-Schmidt (ROBERTS, 1985) utilizando como aldeídos aromáticos: benzaldeído, 4-nitrobenzaldeído, 2-metoxibenzaldeído, 4-metoxibenzaldeído, 2,4-dimetoxibenzaldeído, 5-bromo-2-metoxibenzaldeído e como cetonas aromáticas: acetofenona e 4-nitroacetofenona. Os rendimentos dessas reações variaram de 40 a 85%, Esquema 2.
Os produtos das reações descritas no Esquema 2, foram, quando houve necessidade, purificados por recristalização e analisados por infravermervelho observando-se a deformação axial do grupo carbonila conjugado com a dupla ligação. A caracterização de todas as chalconas foi feita por ponto de fusão.
CONCLUSÕES: Os resultados observados são bastante satisfatórios. Algumas reações apresentadas necessitam serem repetidas para otimização de rendimento.
Dando continuidade aos nossos objetivos, as chalconas serão convertidas nas respectivas α,β-epoxicetonas aromáticas por epoxidação com H2O2 30% em meio alcalino e posteriormente, serão utilizadas no estudo da clivagem de anéis de epóxidos com DTU em condições de transferêcia de fase.
AGRADECIMENTOS:PRPPG-UFES
REFERÊNCIAS BIBLIOGRÁFICA:dos SANTOS, R. B.; BROCKSOM, T. J.; BROCKSOM, U.; Tetrahedron Lett. 38, 745, (1997).
dos SANTOS, R. B.; LUBE, L.M.; 28a. Reunião Anual da Sociedade Brasileira de Química, Livro de Resumos, (2005).
ROBERTS, R.M.; GILBERT, J.C.; RODEWALD, L.B.; WINGROVE, A.S.; “Modern Experimental Organic Chemistry”, 4th Edition, Saunder College Publishing, (1985).
