ÁREA: IC-Iniciação Científica
TÍTULO: ESTUDO CINÉTICO DA REAÇÃO DE DESPROPORCIONAMENTO DO PERÓXIDO DE HIDROGÊNIO, FRENTE A COMPLEXOS DO TIPO [MN(L)NCL2], ONDE L = IMIDAZOL, 1,10-FENANTROLINA, 2,2´-BIPIRIDINA, COM IMIDAZOL
AUTORES: OLIVEIRA, R. M. M. - UFMA; BEZERRA, C. W. B. - UFMA; NETO, B. S. L. - IQSC/USP; SCHULTZ, M. S. - IQSC/USP
RESUMO: Os complexos do tipo [MnL2Cl2], onde L = 2,2´-bipiridina (bipy), 1,10-fenantrolina (phen) e imidazol (imz), foram utilizados nos estudos cinéticos da reação de desproporcionamento do peróxido de hidrogênio (3%H2O2), na presença de imidazol. Utilizou-se técnica volumétrica para avaliar a quantidade de oxigênio (O2) produzido nessa reação, obtendo-se gráficos da variação do volume de O2 em função do tempo. Os estudos foram realizados sob condições de pseudo-primeira ordem, de forma que a concentração do imidazol excedia em pelo menos 50 vezes a concentração do complexo reagente. Experimentos a várias temperaturas (5, 15, 25, 35, 45oC) nos permitiram calcular os parâmetros de ativação. Os dados cinéticos e termodinâmicos sugerem que o mecanismo da reação é de natureza associativa.
PALAVRAS CHAVES: complexos, cinética, peróxido de hidrogênio
INTRODUÇÃO: O peróxido de hidrogênio é produzido no interior do organismo e pode funcionar tanto como um sinalizador biológico, quanto uma toxina . Como agente sinalizador e regulador diminui a quantidade de enzimas existentes no interior das células, controlando funções bioquímicas essenciais para a manutenção da vida. Mas, quando em excesso, torna-se uma toxina, pois o H2O2 pode reagir com metais redox-ativos como ferro e cobre, produzindo as hidroxilas, as quais podem atacar o material genético humano, modificando os sítios das bases nitrogenadas do DNA. Sem os dados perdidos por esse ataque ao material genético, a célula inicia uma multiplicação sem freios, característica do câncer. No entanto, diversos complexos de manganês funcionam como agentes reguladores da quantidade dessa substância no interior das células(BASOLO, 1982). Complexos de manganês são importantes no entendimento de mecanismos de reações fundamentais de compostos organometálicos(WILEY, 1995). Portanto, há grande interesse na preparação e caracterização de complexos de manganês para a compreensão da ação dos catalisadores naturais nos processos enzimáticos.
MATERIAL E MÉTODOS: Síntese dos complexos: [MnL2Cl2], onde L = bipy, phen e imz. Dissolveu-se 0.492g (3.15mmol) de 2.2´-bipiridina em 15mL de etanol e, em seguida, adicionou-se 0.25g (1.2635mmol) de MnCl2.4H2O2 e dissolveu-se. A mistura foi levemente aquecida e agitada por 30 minutos. O produto foi filtrado, lavado com pequenas porções de etanol, seco a vácuo e armazenado. O rendimento foi de 72%. O procedimento das sínteses dos demais complexos, com os ligantes 1,10-fenantrolina e imidazol, foi idêntico ao realizado com a bipy, com rendimento de 65% e 80%, respectivamente. Os complexos foram caracterizados por infravermelho, condutividade molar e análise elementar. Utilizando-se técnica volumétrica foram realizados experimentos para avaliar-se a quantidade de oxigênio produzido pela reação de desproporcionamento do peróxido de hidrogênio. Experimentos a várias temperaturas nos permitiram calcular os parâmetros de ativação, entalpia e entropia, usando-se a expressão de Eyring: ln(k / T) = ln(f . kB / h) – H / RT + S / R. A energia de ativação e a energia livre de Gibbs foram calculados através da equação: Ea = H + RT e G = H - TS, respectivamente.
RESULTADOS E DISCUSSÃO: Comparando-se os valores das freqüências de estiramento entre ligante livre e coordenado, observa-se que as principais bandas nos dois espectros na região do infra vermelho, tem valores próximos, sugerindo a coordenação do ligante ao metal. Titulações condutométricas com nitrato de prata, sugerem a presença de dois íons cloreto em cada complexo. Dados da análise elementar mostram concordância entre os valores experimentais e teóricos para os elementos C, N e H, sugerindo as formulações propostas. A figura 1 mostra os gráficos do volume de O2 produzido pela reação de decomposição do H2O2 versus tempo, com os diferentes complexos.
Tabela 1 – Dados cinéticos e termodinâmicos para a reação de desproporcionamento de H2O2 (3%) frente aos complexos [Mn(L)2Cl2] na presença de imidazol.
L H(Kcal.mol-1) S (cal.mol-1.K-1) G (Kcal.mol-1) Ea (Kcal.mol-1)
phen 23,82 -4,35 25,70 24,41
bipy 25,02 -2,62 26,39 25,61
Imz 17,35 -21,8 24,43 17,94
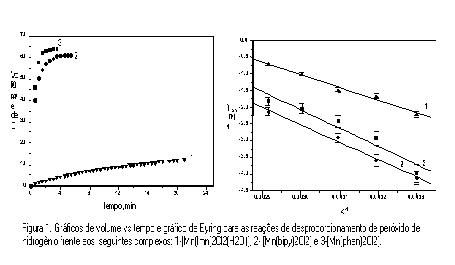
CONCLUSÕES: Os complexos [Mn(bipy)2Cl2] e [Mn(phen)2Cl2] mostraram-se bons catalisador para a reação de desproporcionamento do peróxido de hidrogênio, ao contrário docomplexo [Mn(Imn)2(H2O)2Cl2]. Conclui-se que, a presença dos ligantes bidentados (phen e bipy) na esfera de coordenação do metal, acelera significativamente a velocidade da reação. Implicações de potencial redox devem ser fatores importantes para a reação. Os valores de entropia de ativação, para os três complexos, sugerem que o mecanismo da reação é de natureza associativa.
AGRADECIMENTOS:Ao CNPq/PIBIC/UFMA pelo apoio financeiro; ao LPQIA, ao IQSC/USP.
REFERÊNCIAS BIBLIOGRÁFICA:BASOLO, F. & PEARSON, R.G. “Mechanisms of Inorganic Reactions”, John Wiley &
Sons, New York, 1982.
WILEY, J. & Sons. Encyclopedia of Inorganic Chemistry. New York, , v.4, p. 2076, 1995.
